Скорость - реакция - разложение
Cтраница 1
Скорости реакций разложения обычно или превышают скорости реакций окисления, ли имеют один и тот же порядок. Из этого следует, что процессы термического разложения и превращения исходных продуктов могут протекать в зонах пламени незначительной толщины и за очень короткое время. [1]
Скорость реакции разложения СаСО3 подчиняется закону Аррениуса, она пропорциональна разности между равновесным давлением двуокиси углерода и давлением, поддерживаемым в шахте печи. Лимитирующей стадией процесса диссоциации является скорость образования кристаллических зародышей окиси кальция, которая, в свою очередь, зависит от скорости диффузии ионов металла. Более благоприятные условия для зарождения кристаллов СаО создаются при повышении температуры. [2]
Скорость реакции разложения гидразина во всех изученных случаях пропорциональна количеству взятого катализатора. Реакция разложения является гетерэгенной каталитической реакцией. [3]
Скорость реакции разложения сильно меняется в зависимости от количества и концентрации кислоты. В случае применения 10 % - ного раствора серной кислоты для полного разложения гидроперекиси требуется около 1 ч, тогда как в присутствии 1 % - ного раствора кислоты - 5 ч, а при применении 94 - 96 % - ной серной кислоты в количестве 0 1 % от веса гидроперекиси - менее одной минуты. [4]
Скорость реакции разложения ацетальдегида ( этаналя), имеющего второй кинетический порядок, была намерена в ицтерналс температур 700 - 850 К; константы скорости приведены ниже. [5]
Скорость реакции разложения NO при низких температурах незначительна, поэтому, хотя окись азота при таких температурных условиях термодинамически неустойчива, заметного разложения NO не происходит. Так, для разложения чистой окиси азота на 50 % при 1230 С требуется 197 с, а при 2630 С - всего 2 1Q - с. Теоретический выход азотной кислоты на 1 кВт ч затраченной энергии соответствует получению 2500 г HN03, в действительности на 1 кВт ч получается 55 - 80 г кислоты. [6]
Скорость реакции разложения NO при низких температурах незначительна, поэтому, хотя окись азота в этих температурных условиях термодинамически неустойчива, заметного разложения NO не происходит. Так, для разложения чистой окиси азота на 50 % при 1230 С требуется 197 сек, а при 2630 С всего 2 - 10 - сек. Теоретический выход азотной кислоты на 1 кет - ч затраченной энергии соответствует получению 2500 г HNO3, в действительности на 1 кет - ч получается 55 - 80 г кислоты. [7]
Скорость реакции разложения перекиси при полимеризации приближенно выражается уравнением первого порядка. [8]
Скорость реакции разложения фосфатов серной кислотой с повышением температуры 9293 ] 08 от 50 до 90 - 100 и выше сильно возрастает. [9]
Скорость реакции разложения окиси азота при низких температурах мала, поэтому, несмотря на то, что окись азота при этих температурах термодинамически неустойчива, она заметно не разлагается. Так, время, необходимое для разложения чистой окиси азота на 50 %, при 1230 составляет 197 сек. Поэтому окисление азота воздуха стремятся проводить при высоких температурах, при которых возможно получение повышенного количества окиси азота. [10]
Скорость реакции разложения водяного пара имеет один порядок со скоростью реакции восстановления углекислоты. Однако реакция разложения водяного пара протекает несколько медленнее и высота слоя, необходимая для завершения разложения водяного пара, по исследованиям Н. А. Фуфрянского, в 1 5 - 2 раза превышает соответствующую высоту, необходимую для восстановления углекислоты. [11]
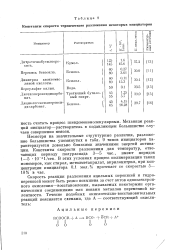 |
Константы скорости термического разложения некоторых инициаторов. [12] |
Скорость реакции разложения ацильных перекисей и гидроперекисей может быть резко повышена за счет актов одноэлектрон-ного окисления-восстановления, вызываемых некоторыми органическими соединениями или ионами металлов переменной валентности. [13]
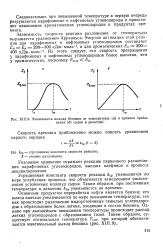 |
Зависимость выхода бензина от температуры ( о и времени пребывания ( б сырья в реакторе. [14] |
Зависимость скорости реакции разложения от температуры выражается уравнением Аррениуса. [15]
Страницы: 1 2 3 4