Хлорный ангидрид
Cтраница 2
Образование небольших количеств хлорного ангидрида происходит при фотохимической и термической реакции между хлором и озоном. [16]
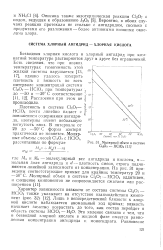 |
Молярный объем в системе С12О7 - НС1О4. [17] |
Безводная хлорная кислота и хлорный ангидрид при комнатной температуре растворяются друг в друге без ограничений. Есть сведения, что при низких температурах гомогенность этой жидкой системы нарушается [13, 17], однако удалось измерить Плотность и вязкость во всем интервале концентраций системна С1207 - ИС. [18]
Точно так же добавление хлорного ангидрида к безводной кислоте не ведет к полному исчезновению моногидрата в системе, а лишь к понижению его концентрации. [19]
Все методы лабораторного получения хлорного ангидрида основаны на взаимодействии сильного водоотнимающего средства с концентрированной хлорной кислотой. [20]
На фосфорном ангидриде и метафосфорной кислоте хлорный ангидрид адсорбируется без химического взаимодействия. При попадании капель ангидрида на бумагу, дерево и подобные материалы он испаряется без взрыва. [21]
 |
Интегральная теплота растворения смесей С12О7 и НС1О4 в воде при 25 С. [22] |
Приведенные сведения показывают, что в системе хлорный ангидрид - хлорная кислота отсутствует сколько-нибудь заметное взаимодействие компонентов. [23]
Как все вещества с молекулярной решеткой, хлорный ангидрид - легкоплавкое вещество, при обычных условиях - летучая, маслянистая, при этом сильно взрывчатая ( жидкость. [24]
Как все вещества с молекулярной решеткой, хлорный ангидрид - легкоплавкое вещество, при обычных условиях - летучая, маслянистая, при этом сильно взрывчатая жидкость. [25]
Физико-химическое исследование хлорной кисло, ты н хлорного ангидрида. [26]
Рассмотренные выше реакции электрохимического синтеза диперхло-ратперсульфата, хлорного ангидрида, пероксиацетатбисульфата, проведенные впервые в лаборатории, протекают по предложенному выше механизму. [27]
Окиси хлора соответствует хлорноватистая кислота НС1О; хлорному ангидриду - хлорная кислота НСЮ; двуокись хлора, реагируя со щелочами, образует соли двух кислот: хлорноватой НСЮз и хлористой НС. Из кислородных соединений хлора наибольшее практическое значение имеют соли хлорноватистой и хлорноватой кислот. Они получаются действием хлора на растворы щелочей. [28]
Окиси хлора соответствует хлорноватистая кислота НСЮ; хлорному ангидриду - хлорная кислота НСЮ4; двуокись хлора, реагируя со щелочами, образует соли двух кислот: хлорноватой НСЮ, и хлористой НСЮ. Из кислородных соединений хлора наибольшее практическое значение имеют соли хлорноватистой и хлорноватой кислот. Они получаются действием хлора на растворы щелочей. На эту реакцию большое влияние оказывает температура. При действии хлора на раствор щелочи на холоду получаются соли хлорноватистой и соляной кислот. [29]
 |
Интегральная теплота растворения смесей С12О7 и НС1О4 в воде при 25 С. [30] |
Страницы: 1 2 3 4