Хлорный ангидрид
Cтраница 3
Таким образом, растворы хлорной кислоты в хлорном ангидриде в широком интервале концентраций близки по свойствам идеальным. [31]
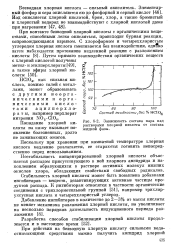 |
Зависимость состава пара над растворами хлорной кислоты от состава жидкой фазы. [32] |
Нестабильность концентрированной хлорной кислоты объясняется распадом присутствующего в ней хлорного ангидрида и накоплением образующихся в растворе активных молекул низших окислов хлора, обладающих свойствами свободных радикалов. [33]
Из двух радикалов, первично возникающих при термическом распаде хлорного ангидрида, к более или менее устойчивому существованию способен, по-видимому, лишь СЮз. Жидкость примерно на 99 % состоит из удвоенных молекул ( CljOs), тогда как в парообразном состоянии равновесие CljOs 2 ккал 2С1О3 очень сильно смещено вправо. [34]
Из двух радикалов, первично возникающих при термическом распаде хлорного ангидрида, к более или менее устойчивому существованию способен, по-видимому, лишь СЮз. Жидкость примерно на 99 % состоит из удвоенных молекул ( С12Об), тогда как в парообразном состоянии равновесие CIA 2 ккал z 2C1O3 очень сильно смещено вправо. [35]
Поэтому азотный ангидрид существует в виде единственной модификации, подобно хлорному ангидриду, но в отличие от ангидрида ближайшего аналога азота - фосфора. [36]
Причина неустойчивости хлорной кислоты состоит в распаде присутствующего в ней хлорного ангидрида и накоплении в растворе активных молекул низших окислов хлора, имеющих свойства свободных радикалов. Когда концентрация активных частиц достигает определенной критической величины, зависящей от температуры и состава кислоты, заканчивается период индукции и реакция переходит в быструю стадию. Низшие окислы хлора - двуокись и трехокись действуют на процесс разложения хлорной кислоты автокаталитически. [37]
Поэтому азотный ангидрид существует в виде единств энной модификации, подобно хлорному ангидриду, но в отличие от ангидрида ближайшего аналога азота - фосфора. [38]
Разделив 14 на 7, получаем число атомов хлора в молекуле хлорного ангидрида. Деление 14 на 2 дает число атомов кислорода. [39]
Изучение равновесия в системе С1207 - Н20 в области, богатой хлорным ангидридом [106, 228 229], обосновывает метод получения 100 % - ной хлорной кислоты методом отгонки. [40]
Этот раствор оставляют на сутки при - 10 С, а затем отгоняют хлорный ангидрид на водяной бане. [41]
Если нагревать хлорную кислоту с Р2О5, отнимающим от нее воду, то образуется оксид хлора ( VII), или хлорный ангидрид, С О. [42]
Если нагревать хлорную кислоту с Р2Об, отнимающим от нее воду, то образуется оксид xAopa ( VII), или хлорный ангидрид, СЬО. [43]
При слабом нагревании под уменьшенным давлением смеси безводной НСЮ4 с фосфорным ангидридом ( P2Os) отгоняется бесцветная маслянистая жидкость, которая представляет собой хлорный ангидрид. [44]
Были найдены теплота образования, теплота растворения С 2О7 в воде и зависимость давления его паров от температуры, Фонтейнь [18] изучил спектры комбинационного рассеяния хлорного ангидрида и хлорной кислоты и первый высказал соображения о строении их молекул. [45]
Страницы: 1 2 3 4