Вид - кинетическая кривая
Cтраница 1
Вид кинетических кривых Р и D не меняется, если в первой реакции наряду с промежуточным веществом Р образуется конечный продукт В. [1]
 |
Скорость гидратации в зависимости от вида катиона. [2] |
Такой вид кинетической кривой характерен для многих химических реакций, лимитируемых образованием и ростом зародышей новой фазы. [3]
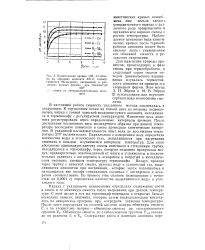
По виду кинетических кривых ( см. рис. 1 - 3) можно сделать вывод, что порядок реакции близок к нулевому. Расчеты по формулам ( 1) и ( 2) подтверждают этот вывод: значения константы скорости К, вычисленные при условии 0-го порядка реакции, имеют небольшие и при том несистематические отклонения от средних величин, тогда как значения, вычисленные при условии 1-го порядка, существенно больше и систематически отклоняются от средних значений К. [4]
 |
Кинетические кривые ОН-С1-обме-на на образцах анионита АВ-17, подвергавшихся 96-часовому нагреванию в различных ионных формах при температуре. [5] |
Наблюдаемое изменение вида кинетических кривых после термообработки анионита может быть связано лишь с уменьшением его обменной емкости в результате нагревания. [6]
При таком механизме вид кинетической кривой получает следующее объяснение. Начальная бурная реакция образования нитрометана, сопровождающаяся генерированием активных центров, часть из которых начинает окислительные цепи, приводит к ликвидации периода индукции. Это значение следует рассматривать только как приближенное, поскольку стерический фактор реакции вырожденного разветвления неизвестен и может оказаться еще меньшим. Таким образом, вырожденное разветвление приобретает уже меньшее значение, и кинетическая кривая имеет вид неразветвленной реакции. [7]
 |
Вид кинетических кривых термического превращения СоРз в интервале температур 250 - 400 С. 1 - 300 С. 2 - 400 С. 3 - 300 С, образец охлажден до комнатной температуры и снова введен в горячую зону. [8] |
На рис. 1 приведен вид кинетических кривых в интервале температур 250 - 400 С. [9]
Действительно, уже самый вид кинетических кривых АР - t верхнетемпературного и холоднопламенного окисления углеводородов столь различен, а для холоднопламенного окисления настолько далек от - образной формы, что М. Б. Нейман счел даже необходимым поставить специальные опыты для доказательства цепного характера процессов, происходящих во время периода индукции холодного пламени. [10]
В нашем случае сам вид кинетической кривой расходования гипохлорита во времени свидетельствует ( рис. 2.16), что порядок реакции по Са ( СЮ) 2 отличен от нулевого. [11]
 |
Типичные кривые зависимости концентрации от времени, при помощи которых можно получить кинетические данные. [12] |
Полученные результаты представляют графически в виде кинетических кривых, подобных кривым, приведенным на рис. 12.1 Любое изменение условий эксперимента может привести к изменению формы или положения экспериментальной кривой. [13]
 |
Изменение концентрации диоксида углерода ( % об. [14] |
Снижение температуры до 450 С существенно изменяет и вид кинетических кривых, и роль добавок щелочных металлов. На рис. 2.24 представлены полученные в этой же работе кинетические кривые изменения массы зауглероженных образцов промотированного оксида железа в процессе регенерации при 450 С и кривые изменения содержания СО2 в процессе регенерации. [15]
Страницы: 1 2 3 4