Сравнение - энергия
Cтраница 1
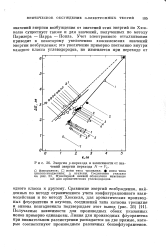 |
Энергия р-перехода в зависимости от значений энергии перехода N - - Vt. [1] |
Сравнение энергий возбуждения, найденных по методу ограниченного учета конфигурационного взаимодействия и по методу Хюккеля, для ароматических производных флуорантена и азулена, соединений типа катиона тропилия и аниона пентадиенила подтверждает этот вывод ( рис. 26) [11], Получаемые зависимости для производных обоих указанных ионов примерно одинаковы. Линия для производных флуорантена при внимательном рассмотрении распадается на две прямые, которые соответствуют производным различных бензофлуорантенов. [2]
Диалогичное сравнение энергий второй зоны дает для матричного элемента W между р-состояниями ту же зависимость, но с другим коэффициентом. Эта простейшая модель не так хорошо отражает реальную ситуацию, однако в качестве иллюстрации она превосходна. Прежде чем перейти к более реалистическим моделям, мы должны более точно определить обозначения, которые будут использоваться для обобщенных матричных элементов межатомного взаимодействия. [3]
Сравнение энергий диссоциащи двух одинаково построенных молекул позволяет судить об их сравнительной устойчивости по отношению к распаду на атомы, о прочности химической связи в них. [4]
Сравнение энергий ионизации метилпроизводных мочевины разной степени замещения позволило заключить, что в их М зйряд локализуется преимущественно на N-атоме. [5]
Сравнение энергий типичных связей углерода и кремния позволяет сделать ряд выводов. [6]
Сравнение энергий образования гидридов элементов VI группы указывает на падение прочности связи при переходе от О к Ро, что и естественно как нормальный ход в отсутствие усложняющих эффектов повышения валентного состояния. Такое усложнение наблюдается в случае окислов. [7]
Интересно сравнение энергий, приходящихся на одну Н - связь, в комплексах разной сложности. В этой же работе для цепей ( HF) 2, ( HF) 3, ( HF) 4 ( HF) 6 и кольца ( HF) 6 получены ЛЕ на одну Н - связь ( в ккал / моль) 6 92; 7 78; 8 27; 8 81; 9 43 и соответствующие величины FF 2 43; 2 40; 2 39; 2 37 и 2 34 А. Циклы с асимметричным расположением атомов водорода устойчивы по отношению к распаду на димеры. Циклы с симметричным расположением атомов водорода менее прочны, но оценка энергии корреляции электронов показала, что и они могут быть устойчивы к распаду на мономеры. Последние циклы характеризуются малыми электронными зарядами на атомах водорода Н - связей. [8]
Для сравнения энергии этой структуры с энергией обычного гексагонального нитрида бора был проведен расчет, в котором, как и в случае хлорида меди, использовался потенциал 6 - 12 при радиусе сферы суммирования 20 А. [9]
Из сравнения энергий диссоциаций связей С - С и С - Н следует, что в углеводородах связи С - Н значительно прочнее, чем связи С - С. Следовательно, первичным актом распада углеводородной молекулы должен быть разрыв одной из С - С связей. [10]
Кроме сравнения энергии химических связей, анализа различных термодинамических параметров, для объяснения причины возникновения ликвации может быть полезным проведение сравнения значений силы поля катионов ( по Дитцелю Z / г2, где Z - валентность, г - радиус иона), поскольку именно сила поля катиона, например, для простых силикатных систем, согласно данным [773], является основным фактором, определяющим область ликвации. По-видимому, это положение может быть в определенной степени применено и к халькогенидным системам. [11]
Однако сравнение энергий диссоциации молекул галогенидов элементов III группы ( A1F, А1С1 и др.), полученных различными методами, привело Велти и Барроу [4203] к выводу, что линейная экстраполяция колебательных уровней основного состояния рассматриваемой группы молекул дает слишком низкие значения энергий диссоциации, которые составляют приблизительно 50 - 70 % от действительного значения. [12]
Методом сравнения энергий всегда легче определять частоту, если при колебаниях амплитуды различных точек системы различны, но связаны между собой каким-то определенным условием, на основании которого можно по амплитуде одной точки однозначно определить амплитуды всех остальных точек. [13]
При сравнении энергий первичной и вторичной связей С - Н в пропане видно, что они отличаются на 3 ккал / моль. Поскольку исходное соединение и один из радикалов Н одни и те же, эта разница отражает только различие в стабильности первичного и вторичного радикалов. Подобное же различие в энергии диссоциации изобутана ( СНз) зСН на ( СНз) гСН - СН2 и Н ( 98 ккал / моль) и его же диссоциации на ( СНз) зС и Н ( 92 ккал / моль) отражает различие в стабильности первичного и третичного радикалов. На основании этих данных можно составить ряд относительной стабильности алкильных радикалов: третичный вторичный первичный. [14]
При сравнении энергии присоединения для аналогичных амминокатионов и аквокатионов оказывается, что в случае неблагородногазовых катионов энергия присоединения молекул аммиака значительно выше, чем энергия присоединения равного числа молекул воды. В случае иона Mg2 обе величины практически не отличаются друг от друга, и, наконец, в случае щелочноземельных металлов присоединение молекул воды сопровождается большим энергетическим эффектом, чем присоединение равного числа молекул аммиака. Последовательное присоединение молекул аммиака к центральному катиону сопровождается неодинаковым энергетическим эффектом: каждая последующая молекула присоединяется с уменьшающимся выделением тепла. [15]
Страницы: 1 2 3 4