Слабокислая среда
Cтраница 2
В слабокислой среде восстановлению нитросоединений предшествует их прото-низация, характер которой, однако, отличается от того, который имеет место в случае квази-диффузионных волн. Зависимость ЕЧ, от рН квази-диффузионных волн определяется не кинетикой предшествующей протонизации, а лишь протолитическим равновесием, при котором из-за диссоциации уменьшается концентрация электрохимически активных частиц. Поэтому в уравнения для ЕЧ, [ ( 71) и ( 74) ] входит не кинетическая константа скорости р, а константа равновесия а или К. [16]
В слабокислой среде устойчивость V ( - - 5) возрастает. Кроме того, в кислой среде образуются не катионы V4 или V5, а их оксопроизводные - ванадилы. [17]
В слабокислой среде этот реактив осаждает Си ( II), Pd ( II), Co ( III), Fe ( III), Cr ( III), Ti ( IV), V ( IV), W ( IV), Zr ( IV), Sn ( IV), которые могут быть отделены от Mn ( II), Ni ( II), Zn ( II), ионов ще -, лочноземельных металлов, Al ( III), Sb ( V) и др. Особенно удобен этот реактив для отделения Со ( П) от Ni ( II), так как под его воздействием Со ( П) окисляется до Со ( Ш) и осаждается в виде соответствующего нерастворимого комплекса. При нагревании полученные комплексы подвергаются частичному окислению и разложению, вследствие чего предпочитают их прокаливать и взвешивать в виде оксидов металлов. [18]
В слабокислой среде и при концентрации [ Ре ( С1Ч) в ] 4 - - ионов не больше 12 мг / л образующаяся берлинская лазурь не выпадает в осадок, а остается в виде устойчивого коллоидного раствора. [19]
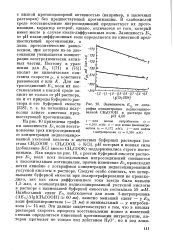 |
Зависимость Е, от логарифма концентрации недиссоциированной СНзСООН в растворе при рН 4 60. [20] |
В слабокислой среде восстановлению нитросоединений предшествует их прото-низация, характер которой, однако, отличается от того, который имеет место в случае квази-диффузионных волн. Зависимость ЕЧ, от рН квази-диффузионных волн определяется не кинетикой предшествующей протонизации, а лишь протолитическим равновесием, йри котором из-за диссоциации уменьшается концент - - рация электрохимически актив - ных частиц. Поэтому в урав - нения для ЕЧ, [ ( 71) и ( 74) ] входит не кинетическая константа скорости р, а константа равновесия а или К. [21]
В слабокислой среде в присутствии комплексона III и роданида с дитизоном, помимо ртути, вступают в реакцию также трехвалентное золото и, вероятно, двухвалентная платина. Однако эти элементы на практике в водах не встречаются. [22]
В слабокислой среде и при большом избытке молибдата ( менее чем 1 5 моль соляной кислоты на 1 моль молибдата) образуется а-форма; эта форма менее интенсивно окрашена, но устойчива в более широком интервале кислотности. [23]
В слабокислой среде ( рН 4 5 - 5) в растворе находится Na [ RhYH2O ], который используют для спектрофотометрического и полярографического определения родия. [24]
В слабокислой среде с увеличением содержания в растворе НС1 степень диссоциации аминогрупп повышается. В результате электростатическое отталкивание групп - RNH возрастает и происходит развертывание молекулярных клубков полиамфолита. Это сопровождается увеличением вязкости и уменьшением мутности раствора. При значительном содержании НС1 ( большое количество хлорид-ионов) степень диссоциации основных групп понижается в результате образования солевой формы RNHaCl, а эффективные размеры молекулы снова уменьшаются. [25]
В слабокислой среде при рН 4 только ионы меди, железа и кобальта мешают определению никеля. Но медь легко маскируется тиосульфатом, железо - пирофосфатом. [26]
В слабокислой среде в присутствии комплексона марганец количественно окисляется перекисью свинца до рубиново-красного комплекса трехвалентного марганца. [27]
В слабокислой среде в присутствии комплексона только серебро и одновалентный таллий осаждаются иодидом калия, так как остальные катионы, как, например, свинец, висмут и медь, прочно связаны в комплекс и с иодидом не реагируют. В нейтральной среде серебро образует комплексное соединение Ag2Y2 -, как было установлено амперометрическим титрованием его комплексоном [114], и не осаждается иодидом. Подробным исследованием этой реакции показано, что только в нейтральной среде можно потенциометри-чески определить серебро - при помощи серебряного индикаторного электрода. В кислых растворах, в которых происходит выделение иодида серебра, результаты всегда получаются пониженными. Авторы рекомендуют следующий ход определения. К раствору, содержащему не менее 1 мг серебра, прибавляют требуемое количество комплексона и 5 капель бромтимолового синего. Присутствующий в небольшом избытке комплексен на определение не влияет. Таким путем можно определить серебро в присутствии свинца, меди, висмута, кадмия даже и тогда, когда они присутствуют в 300-кратном избытке. Пятивалентный мышьяк и трехвалентная сурьма ( связанные в растворе винной кислотой), не влияют на определение. Присутствие двухвалентной ртути и катионов группы бария делает определение невозможным. Согласно авторам, метод можно с хорошими результатами применять для анализа различных сплавов с серебром. После их растворения в азотной кислоте к раствору прибавляют комплексон и винную кислоту ( в присутствии сурьмы), нейтрализуют едким натром и титруют описанным способом. [28]
В слабокислой среде при рН 3 - 4 фенилгидроксиламин является основным продуктом катодного процесса при потенциале, недостаточном для его дальнейшего восстановления. При достаточно отрицательном потенциале фенилгидроксиламин в этих условиях подвергается дальнейшему восстановлению до анилина. [29]
В слабокислой среде NOj-ионы восстанавливаются до NOi - - ионов. Образующиеся при этом МО Г - ионы могут быть обнаружены любой из ниже приводимых реакций на МСГ ионы. [30]
Страницы: 1 2 3 4