Сильнокислая среда
Cтраница 1
Сильнокислая среда, в условиях которой HNCS менее диссоциирована, препятствует реакции; умеренная же кислотность раствора желательна, так как ослабляет гидролиз солей железа. [1]
Сильнокислая среда раствора необходима в этом опыте для подавления гидролиза комплексных ионов хрома. Измерение электропроводности растворов комплексных соединений является одним из важных методов изучения их строения. [2]
В сильнокислой среде осадок может не выпасть, так как при этом образуется крайне нестойкая кислота H. [3]
В сильнокислой среде первый эфир в процессе гидролиза в значительной степени рацемизуется, что свидетельствует об алкилкислородном направлении реакции в этих условиях. [4]
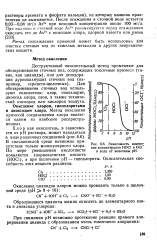 |
Зависимость измене. [5] |
В сильнокислой среде возможно присутствие только молекулярного хлора. [6]
В сильнокислой среде бромат становится очень сильным окислителем. При возрастании величины рН потенциал системы быстро падает, уменьшается и скорость реакции. В слабокислой среде бромат перестает быть окислителем. В объемном анализе бромат используется только в сильнокислой среде. Конец реакции титрования, при достижении которого в растворе появляется свободный бром, обычно обнаруживают по разрушению последним того или иного красителя, например метилового оранжевого или метилового красного. Исчезновение окраски этих красителей необратимо. [7]
В сильнокислой среде мышьяк ( V), присутствующий в виде мышьяковой кислоты H3AsO4, является окислителем, который в присутствии катализатора ( ( например, иодид-ионов) реагирует с достаточной скоростью. [8]
В сильнокислой среде, при нагревании, реакция проходит быстро и количественно. Выделившийся галоген поглощают раствором иодида калия и образовавшийся иод титруют раствором тиосульфата. [9]
В сильнокислой среде бромат становится очень сильным окислителем. При возрастании величины рН потенциал системы быстро падает, уменьшается и скорость реакции. В слабокислой среде бромат перестает быть окислителем. В объемном анализе бромат используется только в сильнокислой среде. Конец реакции титрования, при достижении которого в растворе появляется свободный бром, обычно обнаруживают по разрушению последним того или иного красителя, например метилового оранжевого или метилового красного. Исчезновение окраски этих красителей необратимо. [10]
В сильнокислой среде мышьяк ( V), присутствующий в виде мышьяковой кислоты H3AsO4 является окислителем, который в присутствии катализатора ( например, иодид-ионов) реагирует с достаточной скоростью. [11]
В сильнокислой среде, при нагревании, реакция проходит быстро и количественно. Выделившийся галоген поглощают раствором иодида калия и образовавшийся иод титруют раствором тиосульфата. [12]
 |
Изменение концентрации НОС1 и ОС1 - в воде при изменении рН. [13] |
В сильнокислой среде равновесие этой реакции сдвинуто влево и в воде присутствует молекулярный хлор; при значениях рН4 молекулярный хлор в воде практически отсутствует. [14]
В сильнокислой среде пятичленные гетероциклические соединения утрачивают ароматичность, так как при этом из ароматического секстета уходит пара электронов гетероатома. [15]
Страницы: 1 2 3 4