Электронное строение - соединение
Cтраница 2
ЯМР и ЭПР, выполнили исследования электронного строения окис-ных соединений различных модификаций кремнезема и каркасных алюмосиликатов в кристаллическом и стеклообразном состояниях, окислов переходных элементов, а также окислов с примесями парамагнитных ионов. Установлено характерное электронное строение стекла, не совпадающее ни с одной из кристаллических модификаций. Степень ковалентности структурного каркаса возрастает в последовательности: кварц - алюмосиликатное стекло-тридимит-кварцевое стекло - кристобалит-каркасные алюмосиликаты. Установлено влияние примесей окислов на фазовые переходы, сопровождающиеся изменением электронного строения окислов. [16]
Проведенный выше анализ связи спектров ЭПР с электронным строением соединения наглядно иллюстрирует возможности метода ЭПР в исследовании различных аспектов электронного строения и свойств координационных соединений. Не задаваясь целью охватить все проблемы, решаемые методом ЭПР, перечислим некоторые основные из них. [17]
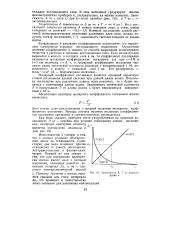 |
Зависимость А, Т от концентрации с. [18] |
Коэффициент k называют коэффициентом поглощения; его определяет электронное строение поглощающего соединения. Абсолютное значение коэффициента k зависит от способа выражения концентрации вещества в растворе и толщины поглощающего слоя. [19]
Значительное число задач содержит теоретические вопросы органической химии; электронное строение соединений, механизмы реакций, виды изомерии, в том числе конформации и др. Много внимания уделяется связи строения органических соединений с их реакционной способностью. Должное место занимают также задачи по классической теории химического строения. В настоящем сборнике представлены элементоорганиче-ские соединения, которые введены в программу по органической химии для педагогических вузов. [20]
Однако существуют две важные особенности, которые отличают исследование электронного строения соединений переходных металлов от всех других разделов теории валентности. Первая - присутствие частично заполненных d - и f - оболочек. Это дает возможность использовать экспериментальные методы, неприменимые в большинстве других случаев, а именно изучение парамагнетизма, спектров поглощения в видимой области и кажущейся нерегулярности в изменении термодинамических и структурных свойств. Вторая - возможность использования грубого, но весьма полезного приближения, получившего название теории кристаллического поля, которое представляет мощный, но вместе с тем достаточно простой метод для описания таких свойств и их корреляции с наличием частично заполненных оболочек. [21]
Рассмотрим с этой точки зрения связь термоэлектрических свойств с электронным строением соединений переходных элементов. [22]
Это обстоятельство важно для понимания происхождения химической связи при анализе электронного строения соединений по схеме МО, ибо оно показывает, что не внешние ( валентные) одноэлектронные состояния образуют связь, а внутренние состояния, некомпенсированные разрыхляющими МО. Отсюда, в частности, очевидно, что стремление охарактеризовать химическую связь только по данным электронного парамагнитного резонанса ( и ему подобным), относящимся к состоянию неспаренных электронов, вообще говоря необосновано. [23]
Нужно сказать, что в последнее время эта чрезвычайно любопытная особенность электронного строения соединений типа R-Аг ( где R - заместитель типа - С) отмечена в ряде независимых исследований. Петерст [59] путем квантово-ме-ханичеоких расчетов пришел к выводу об отсутствии сопряжения с ядром заместителей, не имеющих ib а-положеи. [24]
Отсюда видно, что спектры ЭПР несут очень богатую информацию об электронном строении соединения. [25]
Наряду с традиционной задачей синтеза новых соединений современная химия уделяет большое внимание изучению электронного строения соединений и его связи с физико-химическими свойствами. Область химических исследований настолько расширилась, число эмпирических закономерностей, установленных для отдельных классов соединений, настолько велике, что желание исследователя навести порядок в море экспериментальных фактов сейчас не только естественно, но и необходимо. Это может быть сделано лишь с привлечением новейших физических методов, как экспериментальных, так и теоретических. [26]
Наиболее простой и в то же время наиболее точной областью квантовой химии является теория электронного строения соединений с кратным. При расчете ненасыщенных соединений обычно используют так называемое т, я-приближенис. [27]
Здесь приведены только первые потенциалы ионизации соединении. Большой интерес для выяснения электронного строения соединений представляет также исследование их более высоких потенциалов ионизации, которое выполняется методом фотоэлектронной спектроскопии. Этот метод, предложенный почти одновременно А. Аль-Джобури в Англии ( 1961 - 1962 гг.), бурно развивается в настоящее время. [28]
Наиболее известным примером невозможности передать электронное строение соединения одной схемой связей атомов ( т.е. одной классической структурной формулой) является молекула бензола. [29]
Ниже излагается предложенный недавно [19] другой подход к освещению задачи. В его основе лежит анализ электронного строения соединений, и в этом смысле содержание данного раздела некоторым образом предвосхищает результаты последующих глав. [30]
Страницы: 1 2 3 4