Аддитивность - энергия - связь
Cтраница 1
Аддитивность энергии связи и других свойств является следствием локализации пары электронов между двумя атомами, образующими связь: молекула рассматривается как сумма отдельных связей, а отсюда и свойства молекулы - сумма свойств связей. [1]
Аддитивность энергий связей проявляется приближенно у неорганических соединений [ к-5 ], [ к-47 ] и особенно четко у органических. [2]
Аддитивность энергии связи и других свойств является следствием локализации пары электронов между двумя атомами, образующими связь: молекула рассматривается как сумма отдельных связей, а отсюда и свойства молекулы - сумма свойств связей. [3]
Эта аддитивность энергии связи впервые была наблюдена Томсеном. [4]
Отклонения от аддитивности энергий связей встречаются особенно часто у веществ, содержащих сопряженные двойные связи, это указывает на определенные особенности в химическом строении молекул таких соединений. Характер этих особенностей можно выяснить, применяя для исследования различные химические и физические методы. Значения теплот образования ряда органических соединений приведены на стр. [5]
 |
Образование о-связи.| Делокализация я-связей в бутадиене. [6] |
Отклонения от аддитивности энергий связей и изменения длин связей, наблюдаемые в молекулах с сопряженными связями, могут быть вызваны как делока-лизацией я-связей, так и различиями в гибридизации атомных орбит, служащих для образования а-связей. С-С образована атомами углерода в состоянии гибридизации хр3, а а-связь между атомами углерода 2 и 3 в бутадиене-1 3 - атомами в состоянии sp2, поскольку одна р-орбита каждого атома идет на образование л-связи. [7]
Отклонения от аддитивности энергий связей встречаются особенно часто у веществ, содержащих сопряженные двойные связи, это указывает на определенные особенности в химическом строении молекул таких соединений. Характер этих особенностей можно выяснить, применяя для исследования различные химические и физические методы. Значения теплот образования ряда органических соединений приведены на стр. [8]
Для средних величин связей правила аддитивности энергии связей удовлетворяются неплохо. Однако для кинетики важны не средние величины энергий связей, определяемые из термохимических данных. Например, при разложении мотана или этана на элементы важно не то, что средняя энергия связи О. Для кинетики интересно, какую энергию надо затратить на отрыв от молекулы одного первого атома водорода. Особенно же сильно отличается энергия разрыва связи С - Н в молекуле. Это в основном определяется том, что электронная плотность распределена между связями неравномерно. В одних связях она больше, чем это отвечает классической картине двух электронов, в других - меньше. Если данная связь имеет меньшую электронную плотность валентных электронов, то разрыв связи облегчается. Чем легче связь разрывается, тем активнее молекула. Таким образом, правило Воеводского получает естественное объяснение. Конечно, нельзя его применять для сравнения активности радикалов совершенно различного химического состава, например, если один радикал получается путем разрыва связи С - Н в молекуле, а другой путем разрыва связи С-С в той же молекуле. В этом случае энергии разрыва разных связей будут различными и для классической картины электронов, закрепленных попарно на связь, и не могут характеризовать активность получаемых радикалов. [9]
Следует, однако, отметить, что аддитивность энергии связей не всегда наблюдается. Это обусловлено структурой вещества. Вследствие этого теплоты образования, полученные суммированием энергии связей, иногда отличаются от экспериментально установленных. [10]
Этот метод представляет собой развитие обычной эмпирической схемы аддитивности энергий связей, в которой учитываются вторичные изменения энергий связей вследствие гибридизации ( разд. [11]
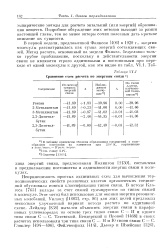 |
Сравнение схем расчета по энергиям связи а. [12] |
Полипгом [ ИЗО ], составлена в предположении постоянства и аддитивности энергии связи в молекулах. [13]
 |
Сравнение схем расчета по энергиям связи а. [14] |
Полингом [ ИЗО ], составлена в предположении постоянства и аддитивности энергии связи в молекулах. [15]
Страницы: 1 2 3