Сульфат - закись - железо
Cтраница 1
Сульфат закиси железа обычно поступает в виде железного купороса ( FeSO4 - 7H2O), кристаллы которого следует растворять в емкости, изготовленной из кислотоупорного материала и оборудованной мешалкой. Концентрация раствора не должна превышать 10 % по тем же соображениям, которые были приведены для сульфата магния. [1]
Сульфат закиси железа вызывает в растворах молибдатов, подкисленных серной кислотой, интенсивно синее окрашивание. [2]
Сульфат закиси железа образует прозрачные светло-зеленые кристаллы, содержащие 7 молекул воды. [3]
Сульфат закиси железа в слабокислой среде восстанавливает анион МО2 - до окиси азота, которая с избытком ионов Fe2 образует непрочные комплексные ионы [ FeNO ] 2 бурого цвета. В этих условиях анион МОз - - не восстанавливается. [4]
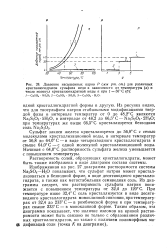 |
Давление насыщенных паров Р ( мм рт. ст. для различных кристаллогидратов сульфата меди в зависимости от температуры ( а и числа молекул кристаллогидратной воды п при t 50 С ( б. [5] |
Сульфат закиси железа кристаллизуется до 56 8 С с семью молекулами кристаллизационной воды, в интервале температур от 56 8 до 64 0 С - в виде четырехводного кристаллогидрата и свыше 64 0 С-с одной молекулой кристаллизационной воды. Начиная с 64 0 С растворимость сульфата железа уменьшается с повышением температуры. [6]
Кристаллогидрат сульфата закиси железа ( Fermm sulfuricum oxydulatum) FeSO4 - 7H2O применяется также в медицине как лекарственное средство. [7]
Железный купорос ( сульфат закиси железа) 7НгО получают в виде отхода при травлении черных металлов серной кислотой. Он представляет собой зеленовато-голубые кристаллы, поверхность которых вследствие постепенного окисления покрывается желтым налетом. [8]
Растворы, содержащие сульфат закиси железа. [9]
Железный купорос ( сульфат закиси железа FeSO4 X X 7Н2О) получают в виде отхода при обработке черных металлов серной кислотой. [10]
Индикатором при титровании служит сульфат закиси железа и диметилглиоксим. [11]
В опытах без кислорода сульфат закиси железа ( соль Мора), добавленный в водную фазу в концентрации 0 05 г-экв / л, не оказывал влияния на выход фенола. В присутствии кислорода наличие ионов Fe2 в смеси заметно увеличивало выход фенола. [12]
Изучая процесс разложения обезвоженного сульфата закиси железа, В. В. Печковокий, С. А. Амирова, А. Н. Кетов ( 12 - 15 ] установили, что добавка углерода снижает температуру начала разложения сульфата закиси железа до 450 С и существенно интенсифицирует процесс. Это особенно наглядно проявляется, когда процесс протекает в кинетической и переходной областях. Процесс разложения в случае восстановления сульфата закиси железа углеродом протекает при температуре не выше 625 С. В диффузионной области увеличение содержания углерода в смеси выше 5 - 10 % практически уже не влияет на степень термохимического разложения сульфата. Указывается, что при содержании в исходной смеси не более 5 - 10 % углерода основными твердыми продуктами разложения являются окислы железа, а сера в газовой фазе находится главным образом в виде сернистого ангидрида. При увеличении содержания углерода в исходной смеси выше 10 - 15 % конечным продуктом восстановления сульфата закиси железа может быть сульфид железа. [13]
Растворить в одной пробирке несколько кристалликов сульфата закиси железа, в другой - сульфата окиси железа. [14]
Почему при действии сероводорода на раствор сульфата закиси железа иногда наблюдается образование белого осадка серы. [15]
Страницы: 1 2 3 4