Сульфат - закись - железо
Cтраница 3
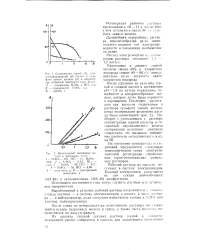
Применение более кислых растворов и нагревание выше 80 приводит к выделению осадка одноводного гичрата сульфата закиси железа - FeSO4 - H2O, растворимость которого в воде в присутствии серной кислоты понижается. [31]
Раствор охлаждают в струе водопроводной воды, приливают из бюретки при перемешивании 0 05 Л7 раствор сульфата закиси железа или соли Мора до перехода желтой окраски шестивалентного хрома в изумрудно-зеленую трехвалентного хрома, а затем 5 - 7 мл избытка. Избыток раствора соли Мора сейчас же оттитровы-вают 0 05 N раствором КМп04 до появления слабо-розовой окраски, не исчезающей в течение 1 мин. [32]
 |
Изотермы растворимости в системе FeSO4 - H2SO4 - H2O ( по Белопольскому. [33] |
Применение для растворения более кислых растворов и нагревание выше 80 приводит к выпадению в осадок одноводного гидрата сульфата закиси железа. [34]
Для окисления пирита и арсенопирита наиболее пригодны тионовые железобактерии ( Thiobacillus ferrooxidans), способные окислять сульфиды, сульфат закиси железа, элементарную серу, тиосульфат и другие ненасыщенные соединения серы. Механизм окисления сульфидов при бактериальном выщелачивании сложен. Считают, что участие тионовых железобактерий в окислении сульфидов может быть прямым и косвенным. [35]
Регенерация рабочего раствора продолжалась 10 - 11 ч, после чего в нем оставалось около 38 е / л сульфата закиси железа. [37]
Ван Альфен [6] получил 1 4-диоксан с помощью непрерывного процесса, состоящего в том, что к этиленгликолю добавляют безводный сульфат закиси железа, нагревают и вводят новые количества этиленгликоля с такой скоростью, с какой отгоняется жидкость из реакционной смеси; при этом большие количества сульфата закиси железа окисляются в сульфат окиси железа, но каталитическое действие от этого не снижается. Единственным недостатком этого метода являются толчки, причиной которых служит оседающий на дно сульфат закиси железа. [38]
В настоящей работе двухкамерный электролизер с ионитовой мембраной был использован для электрохимического окисления ионов железа ( II) в растворах сульфата закиси железа. [39]
Наиболее распространен метод, основанный на предварительном окислении хрома до шестивалентного, который затем восстанавливают до трехвалентного прибавлением избытка титрованного раствора сульфата закиси железа. [40]
Висмутатный метод состоит из окисления двухвалентного марганца до марганцовой кислоты висмутатом натрия в присутствии азотной кислоты, фильтрования, добавления отмеренного избытка сульфата закиси железа и определения этого избытка титрованием перманганатом. [41]
Очистка сточных вод от окислов хрома осуществляется методом седиментации ( оседания взвешенных в жидкости твердых частиц) с предварительным восстановлением шестивалентного хрома сульфатом закиси железа и коагуляцией известью. [42]
Изучая процесс разложения обезвоженного сульфата закиси железа, В. В. Печковокий, С. А. Амирова, А. Н. Кетов ( 12 - 15 ] установили, что добавка углерода снижает температуру начала разложения сульфата закиси железа до 450 С и существенно интенсифицирует процесс. Это особенно наглядно проявляется, когда процесс протекает в кинетической и переходной областях. Процесс разложения в случае восстановления сульфата закиси железа углеродом протекает при температуре не выше 625 С. В диффузионной области увеличение содержания углерода в смеси выше 5 - 10 % практически уже не влияет на степень термохимического разложения сульфата. Указывается, что при содержании в исходной смеси не более 5 - 10 % углерода основными твердыми продуктами разложения являются окислы железа, а сера в газовой фазе находится главным образом в виде сернистого ангидрида. При увеличении содержания углерода в исходной смеси выше 10 - 15 % конечным продуктом восстановления сульфата закиси железа может быть сульфид железа. [43]
Сточные воды, отходящие из системы водооборота первой стадии дегидрирования, перед сбросом в канализацию подвергают очистке от соединений хрома: выделяют простым отстаиванием грубодисперсные примеси, содержащие трехвалентный хром; восстанавливают сульфатом закиси железа шестивалентный хром, проводят коагуляцию известью и вторичное отстаивание для осаждения скоагулированных тонкодисперсных примесей, не уловленных в первичных отстойниках, и восстановленных окислов хрома. [44]
Ван Альфен [6] получил 1 4-диоксан с помощью непрерывного процесса, состоящего в том, что к этиленгликолю добавляют безводный сульфат закиси железа, нагревают и вводят новые количества этиленгликоля с такой скоростью, с какой отгоняется жидкость из реакционной смеси; при этом большие количества сульфата закиси железа окисляются в сульфат окиси железа, но каталитическое действие от этого не снижается. Единственным недостатком этого метода являются толчки, причиной которых служит оседающий на дно сульфат закиси железа. [45]
Страницы: 1 2 3 4