Сульфат - окись - железо
Cтраница 1
Сульфат окиси железа, а также хлорное железо используют в качестве коагулянтов при очистке воды. Хлорное железо является хорошим коагулянтом в щелочной среде. Сульфат окиси железа может применяться в качестве протравы при крашении шерсти. [1]
Сульфат окиси железа получают обычно растворением окиси железа в 75 - 80 % - ной серной кислоте. [2]
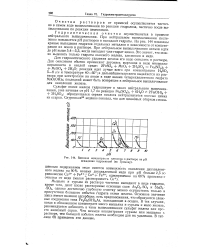 |
Влияние концентрации катионов-в растворе на рН осаждения гидроокисей ( по Громову. [3] |
Сульфат окиси железа гидролизует в чанах нейтрального выщелачивания, уже начиная от рН 1 7 по реакции Fe2 ( SO4) 3 - f - 6H2O S 2Fe ( OH) 3 - f - 3H2SO4; образующаяся серная кислота нейтрализуется окисью цинка из огарка. [4]
Сульфат окиси железа Fe2 ( SO4) s; раствор его применяется в медицине в качестве противоядия при отравлении мышьяком. [5]
Сульфат окиси железа используют гл. CuS, что находит применение при гидрометаллургия, извлечении меди. Железо-аммониевые квасцы применяют как аналитич. [6]
Сульфаты окиси железа, помимо высокой растворимости, являются неустойчивыми соединениями, легко подвергаются гидролизу и выпадают из растворов в виде гидроокислов железа. Этот процесс проходит в четыре этапа. [7]
Сульфат окиси железа Fe2 ( SO4) 3 - белое или желтоватое IFe2 ( SO4) 3 9H2O ] кристаллическое вещество, водный раствор которого вследствие гидролиза окрашен в красно-бурый цвет. Добавление H2SO4 подавляет гидролиз, и раствор становится почти бесцветным. При кипячении разбавленного раствора осаждается основная соль. [8]
Сульфат окиси железа, феррисульфат, Fe2 ( SO4) 3 кристаллизуется из водных растворов в форме 12, 10, 9, 7, 6 и 3-водных кристаллогидратов. Десятиводный кристаллогидрат и безводная соль встречаются в природе в виде минералов квенстетита и коквим-сбита. В водных растворах сульфат окиси железа сильно гидролизуется, особенно при повышенных температурах. Он очень гигроскопичен, на воздухе расплывается. [9]
Сульфат окиси железа, а также хлорное железо используют в качестве коагулянтов при очистке воды. Хлорное железо является хорошим коагулянтом в щелочной среде. Сульфат окиси железа может применяться в качестве протравы при крашении шерсти и в качестве среды для обогащения многосернистых углей. Кислые растворы сульфата окиси железа используют как окислительную среду при извлечении полезных компонентов из рудзэ. [10]
Сульфат окиси железа получают обычно растворением окиси железа в 75 - 80 % - ной серной кислоте. [11]
Сульфат окиси железа быстро регенерируется железобактериями из закис-ной формы, что значительно ( в 7 - 18 раз) ускоряет растворение ряда минералов. [12]
Сульфат окиси железа используют гл. CuS, что находит применение при гид-рометаллургич. Железо-аммониевые квасцы применяют как аналитич. [13]
Сульфат окиси железа, феррисульфат, Fe2 ( SO4) 3 кристаллизуется из водных растворов в форме 12, 10, 9, 7, 6 и 3-водных кристаллогидратов. Десятиводный кристаллогидрат и безводная соль встречаются в природе в виде минералов квенстети-та и коквимсбита. В водных растворах сульфат окиси железа сильно гидро-лизуется, особенно при повышенных температурах. Он очень гигроскопичен, на воздухе расплывается. [14]
Сульфат окиси железа, а также хлорное железо используют в качестве коагулянтов при очистке воды. Хлорное железо является хорошим коагулянтом в щелочной среде. [15]
Страницы: 1 2 3 4