Сульфат - окись - железо
Cтраница 3
Промытый осадок BizSs смывают с фильтра в стакан, прибавляют - 3 г сульфата окиси железа и кипятят 15 мин. После охлаждения прибавляют HaSO4 до растворения осадка, разбавляют до 200 мл в мерной колбе, часть раствора фильтруют и 100 мл фильтрата титруют перманганатом. [31]
Измерены удельные сопротивления ионитовых мембран марок МАК, МАК-В и МКК в растворах сульфата окиси железа с концентрацией от 0.5 до 21 г / л ионов железа. [32]
Растворить в одной пробирке несколько кристалликов сульфата закиси железа, в другой - сульфата окиси железа. [33]
Точно так же при перегреве стенок котла соединения титана переходят в нерастворимые соединения, а сульфат окиси железа - в основные нерастворимые соединения. В результате на стенке котла образуется прочная корка. Во время остывания плава происходит не только его охлаждение, но и дальнейшее разложение. Во время остывания плава его структура меняется вследствие роста кристаллов и поэтому плав приобретает-способность лучше растворяться в воде. Этот процесс называют созреванием плава. [34]
В качестве растворителей при выщелачивании медьсодержащего сырья применяют разбавленную серную кислоту или подкисленные серной кислотой растворы сульфата окиси железа, а также аммиачные растворы. [35]
В качестве растворителей при выщелачивании медьсодержа-щего сырья применяют разбавленную серную кислоту или подкисленные серной кислотой растворы сульфата окиси железа, а также аммиачные растворы. [36]
На рис. 1 показаны величины удельных сопротивлений ионитовых мембран, находящихся в равновесии с растворами, которые содержат разные количества сульфата окиси железа. [37]
Более поздние шаги по извлечению меди из руд электролизом относятся к периоду 1886 - 1905 гг.: Фирма Сименс - Гальске запатентовала способ выщелачивания медного колчедана ( Cu2S) в растворах сульфата окиси железа с последующим электролитическим осаждением меди. [38]
Ван Альфен [6] получил 1 4-диоксан с помощью непрерывного процесса, состоящего в том, что к этиленгликолю добавляют безводный сульфат закиси железа, нагревают и вводят новые количества этиленгликоля с такой скоростью, с какой отгоняется жидкость из реакционной смеси; при этом большие количества сульфата закиси железа окисляются в сульфат окиси железа, но каталитическое действие от этого не снижается. Единственным недостатком этого метода являются толчки, причиной которых служит оседающий на дно сульфат закиси железа. [39]
В нейтральных растворах сульфат окиси железа легко гидроли-зуется с выпадением в осадок гидрата или основных солей окиси железа. Чтобы воспрепятствовать этому, растворы сульфата окиси железа всегда подкисляют серной кислотой, и при этом растворяющее действие на руду оказывает уже не только сульфат, но и кислота. [40]
Употребляется свежеприготовленный раствор: 100 частей сульфата окиси железа растворяют в 300 частях дистиллированной воды. Жидкость перед употреблением сильно взбалтывается. Дается внутрь по столовой ложке каждые 5 - 10 мин в течение часа, после чего промыть желудок. [41]
Полнее всего разработан метод микробиологического выщелачивания меди из различных минералов, в которых медь соединена с серой. Медь вымывается из руды раствором, содержащим сульфат окиси железа, серную кислоту и тионовые бактерии. В результате деятельности бактерий и действия сульфата окиси железа, на - ходящихся в растворе, руда выщелачивается, при этом образуются серная кислота и медный купорос, переходящий в раствор. Этот раствор поступает в цементационную установку, где находятся куски железа. Происходит обменная реакция и образуется сульфат закиси железа, а чистая медь выпадает в осадок. [42]
Этой способностью обусловлена двойная роль этого организма в окислении руд. Во-вторых, окисляя железо, этот организм способствует образованию сульфата окиси железа; это соединение, в свою очередь, служит мощным окислителем сульфидов. По мнению С. С. Смирнова, это вещество может рассматриваться как один из важнейших факторов в процессе переработки сульфидов в качестве поставщика кислорода в различные горизонты зоны окисления, в том числе в наиболее глубокие. [43]
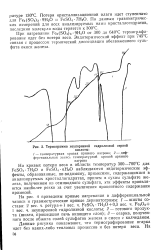 |
Термограмма неупаренной гидролизной серной. [44] |
При нагревании Ре2 ( 5О4) з 9Н2О от 300 до 640 С термографи-рование идет без потери веса. Эндотермический эффект при 745 С связан с процессом термической диссоциации обезвоженного сульфата окиси железа. [45]
Страницы: 1 2 3 4