Существование - реакция
Cтраница 2
Однако существование реакций, протекающих с поглощением теплоты, противоречит принципу Бертло. Он имеет ограниченное значение и, в частности, подтвердился только для эндотермических реакций. Таким образом, тепловой эффект реакции не может служить мерой химического сродства. [16]
Доказательства существования реакций k t и & 4, по-видимому, имеются в работе Андерсона. [17]
Достоверность существования реакций высших порядков, как уже указывалось, очень сомнительна. [18]
Определим область существования реакции псевдопервого порядка из условия М5 R ( см. раздел 2.6); тогда при М 100 R 20 и для заданных выше условий ржэ2 23 - 10 - 5 м / с. Соответственно скорость жидкости на поверхности пленки должна быть выше 2 - 10 - 2 м / с; при меньшем значении wx будет заметно исчерпывание хемо-сорбента вблизи поверхности, а при R5M ( и, следовательно, R500) процесс массопередачи будет протекать в области мгновенной реакции. [19]
Другим доказательством существования реакций горячих радикалов могут служить данные о фотолизе метилиодида. Алкилиодиды имеют непрерывный спектр поглощения в области около 2500 - 2600 А с максимумом вблизи 2600 А. В этой области первичными процессами, сопровождающими поглощение света, являются процессы образования атомов иода и алкильного-радикала. В случае метилиодида энергия связиС - Iпримерно равна 55 ккал. Если атом I возбужден ( 2А / 2), то избыток равен - 35 ккал. Следовательно, если нет какой-нибудь быстрой реакции, включающей горячие метильные-радикалы, то, по-видимому, они должны находиться в этой-системе. [20]
Другим доказательством существования реакций горячих радикалов могут служить данные о фотолизе метилиодида. Алкилиодиды имеют непрерывный спектр поглощения в области около 2500 - 2600 А с максимумом вблизи 2600 А. В этой области первичными процессами, сопровождающими поглощение света, являются процессы образования атомов иода и алкильного радикала. В случае метилиодида энергия связиС - Iпримерно равна 55 ккал. Если атом I находится в основном состоянии ( а. Если атом I возбужден ( 2А / 2), то избыток равен - 35 ккал. Следовательно, если нет какой-нибудь быстрой реакции, включающей горячие метильные радикалы, то, по-видимому, они должны находиться в этой системе. [21]
Основываясь на существовании реакций, рассмотренных выше, большинство исследователей придерживается мнения о наличии прямого химического сопряжения с участием общих промежуточных соединений. Однако были также предложены модели, согласно которым предполагается создание градиента по обе стороны митохондриальной мембраны. Рассмотрим одну из моделей, предложенную Митчеллом, который постулирует хемо-осмоти-ческий механизм сопряжения. [22]
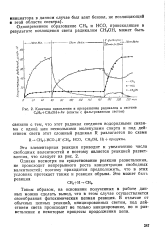 |
Кинетика накопления и превращения радикалов в системе С6Н6 СН3ОН Лу ( опыты с фильтрованным светом. [23] |
Однако несмотря на существование реакции разветвления, не происходит непрерывного роста концентрации свободных валентностей; поэтому приходится предположить, что в этих условиях протекает также и реакция обрыва. [24]
Данные, подтверждающие существование реакций смещения электронов, в основе которых лежит образование или расщепление электронных пар, были уже представлены выше и иллюстрированы рядом примеров. Если мы хотим теперь вооружиться теорией, дающей возможность предсказывать ход реакций, сопровождающихся образованием и расщеплением электронных пар, то ясно, что мы должны сначала еще более углубиться в рассмотрение элементарных законов, управляющих поведением электронов. [25]
Твигг [21 ] предполагает существование реакции обратного распада окиси этилена на этилен и кислород. При окислении этилена, содержащего С14, протекание такой реакции со скоростью, соизмеримой со скоростью генерации окиси этилена, неизбежно должно было привести к изменению удельной радиоактивности исходного этилена во время реакции. Этот вопрос исследован специально ( табл. 20) при различных условиях процесса окисления этилена на серебре. [26]
Сам по себе факт существования реакций, идущих с различными скоростями, был известен с давних времен. Так, еще Вен-цель полагал, что скорость течения химической реакции определяет величину сродства реагирующих веществ. Это предположение оказалось ошибочным и было опровергнуто К. Л. Бертолле, который указал, что сродство не может рассматриваться неизменным. Оно может изменяться в зависимости от массы реагирующих веществ. При определенных условиях некоторые реакции, идущие в одном направлении, при изменении отношения масс реагирующих веществ, могут протекать в обратном направлении. Так было установлено существование обратимых реакций. [27]
Малая инертность подобных процессов объясняет существование реакций, протекающих через стадии, в которых участвуют свободные атомы или радикалы. Взаимодействие водорода с хлором Н3 - f - С12 - 2НС1 является типичным примером цепного процесса. Стадия первичного образования атомов или радикалов ( активных центров), в данном случае СЦ - 2С1, называется зарождением цепи, или ее инициированием. Обычно это самый трудный этап цепной реакции, так как разрыв молекулы на атомы или радикалы требует довольно большой затраты энергии; так, теплота диссоциации молекулы С12 составляет 57 ккал / моль, так что энергия активации процесса С1а - - 2С1 не может быть меньше этой величины. [28]
Может показаться парадоксальным, что существование реакций 1 и 2, приводящих к образованию равновесной концентрации Сг ( V), не вызывает сколько-нибудь значительного обмена. Объясняется это тем, что равновесная концентрация Сг ( V) мала, так что, даже если реакция 1 медленная, небольшие количества Сг ( V), необходимые для установления равновесия, могут быстро образоваться. Наличие лимитирующей стадии Сг ( III) Сг ( V) 2Сг ( IV) может объяснить наблюдаемый закон скорости обмена, если обмен между Сг ( V) и Сг ( VI) идет быстро. [29]
Может показаться парадоксальным, что существование реакций 1 и 2, приводящих к образованию равновесной концентрации Сг ( V), не вызывает сколько-нибудь значительного обмена. Объясняется это тем, что равновесная концентрация Сг ( V) мала, так что, даже если реакция 1 медленная, небольшие количества Сг ( V), необходимые для установления равновесия, могут быстро образоваться. Наличие лимцтирующей стадии Сг ( III) Сг ( V) 2Сг ( IV) может объяснить наблюдаемый закон скорости обмена, если обмен между Сг ( V) и Сг ( VI) идет быстро. [30]
Страницы: 1 2 3 4