Координационная сфера - комплекс
Cтраница 3
Катализатор переходит в исходное состояние. Процессы присоединения молекул водорода и фумаровой кислоты к центральному иону сопровождаются вытеснением лигандов из координационной сферы комплекса. Эти процессы протекают медленно. Процесс перехода Н - к атому С и процесс отщепления молекулы янтарной кислоты сопровождаются просоединением двух лигандов к иону металла. Эти процессы протекают с высокими скоростями и не лимитируют общую скорость процесса. [31]
Катализатор переходит в исходное состояние. Процессы присоединения молекул водорода и фумаровои кислоты к центральному иону сопровождаются вытеснением лигандов из координационной сферы комплекса. Эти процессы протекают медленно. Процесс перехода Н - к атому С и процесс отщепления молекулы янтарной кислоты сопровождаются просоединением двух лигандов к иону металла. Эти процессы протекают с высокими скоростями и не лимитируют общую скорость процесса. [32]
Большая скорость реакции и более низкое значение Еа для системы d3 по сравнению с системой du следуют из теории кристаллического поля. Разность энергий не так велика, как можно было бы ожидать, Полное удаление иона С1 - из координационной сферы пентаамминового комплекса вызывает изменение ЭСКП, которое также можно определить. Таким образом, потеря энергии стабилизации составляет 2Dq, или 12 ккал. Теоретическое значение разности в энергиях активации составляет около 6 ккал. Для механизма диссоциации, которой способствует растворитель, с реализацией в переходном состоянии конфигурации октаэдрическо-го клина ожидаемое значение разности ЭСКП должно быть немного меньше 6 ккал. [33]
Метод ЭПР исключительно эффективен для изучения смешанных комплексов парамагнитных ионов. Установлены основные закономерности изменения параметров спектров ЭПР смешанолигандных комплексов, сформулирована закономерность аддитивного изменения параметров спектров ЭПР в зависимости от числа лигандов данного типа в координационной сфере комплекса, что дает возможность предсказать параметры спектров ЭПР смешанолигандных комплексов и тем самым идентифицировать их спектры. [34]
Общий механизм каталитического действия координационных комплексов сводится к облегчению электронных переходов в общей системе электронов и ядер внутри комплекса, по сравнению с переходами между отдельными молекулами. С этих позиций следует считать, что стадия образования координационных комплексов может ускорять как реакции окисления-восстановления, так и реакции перераспределения валентных связей ( интра - и интермолекулярные), поскольку между различными молекулами, входящими в координационную сферу комплекса в качестве лигандов, взаимодействие облегчается. [35]
Общий механизм каталитического действия координационных комплексов сводится, как указывалось, к облегчению электронных переходов в общей системе электронов и ядер внутри комплекса, по сравнению с переходами между отдельными молекулами. В этом плане следует считать, что стадия образования координационных комплексов может ускорять как реакции окисления - восстановления, так и реакции перераспределения валентных связей ( интра - и иртер-молекулярные), поскольку между различными молекулами входящими в координационную сферу комплекса в качестве лигандов, взаимодействие облегчается. [36]
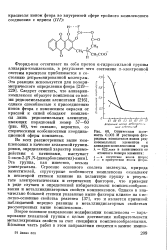 |
Оптическая плотность 0 002 М растворов фто-ридных комплексов ионов редкоземельных элементов с ализарин-комплексоном при А, 622 ммк в зависимости от атомного номера элемента. [37] |
Фторид-ион оттягивает на себя протон а-гидроксильной группы ализарин-комплексона, в результате чего состояние л - электронной системы красителя приближается к состоянию депротонированной молекулы. Следует отметить, что ализарин-комплексон образует комплексы со всеми редкоземельными элементами [216], однако способностью к присоединению ионов фтора с изменением окраски от красной к синей обладают комплексы лишь редкоземельных элементов, имеющих порядковый номер 57 - 60 ( рис. 68), что связано, вероятно, со стерическими особенностями координационной сферы комплекса. [38]
Литандообмен ная хроматография отличается от ионообменной, адсорбционной и других видов хроматографии именно природой взаимодействия разделяемых соединений со стационарной фазой. В данном случае это взаимодействие не является непосредственным, а осуществляется через координационную сферу комплексообразующего иона металла. Молекулы или ионы, составляющие координационную сферу комплекса, называются лигандами. Осуществляемый в хро-матографическом режиме обмен лигандов при центральном ионе металла и дает название лигандообменной хроматографии. В зависимости от того, фиксирован ли комплексообразующий ион металла на стационарной фазе или перемещается с подвижной фазой, следует различать две разновидности лигандообменной хроматографии: хроматографию лигандов и хроматографию комплексов соответственно. [39]
Активирование реагента X - Y при его координации с металлом может приводить к полному разрыву одной из связей в его молекуле. При этом образовавшиеся фрагменты X и Y или один из них оказываются в координационной сфере комплекса и претерпевают дальнейшие превращения. Различают три типа диссоциативного присоединения X - Y к металлу: окислительное, гемолитическое и гетеролитическое. [40]
 |
Зависимость / пр. от состава смешанного растворителя. [41] |
Было обнаружено [27], что электровосстановление оловоорга-нических соединений типа R2SnCl2 и R3SnCl ( R С2Н5, С4Н9, СвН5) на фоне хлоридов в апротонных растворителях ( диметил-формамиде и дифенилсульфоксиде) осложнено предшествующими лереносу электрона химическими реакциями. Это объяснено авторами работы образованием в растворе смешанных комплексов оловоорганических веществ с растворителем и ионами хлора в качестве лигандов. По мнению авторов [27], молекулы растворителя и ионы хлора конкурируют за место в координационной сфере комплекса. При этом скорость замены в комплексе ионов хлора молекулами растворителя определяет величину соответственно суммарного и первого кинетических токов. [42]
 |
Зависимость коэффициента диализа от рН для комплексов Ри ( III с глутаминовой кислотой (. и серином ( 2. [43] |
Полученные экспериментальные данные представлены на рис. 2, из которого следует, что при низких значениях рН величина А мало зависит от изменения концентрации ионов водорода. При рН 5 - 6 происходит резкое изменение коэффициента диализа, что, вероятно, связано не только собственно с комплексообразованием в этой области, но и с образованием гидроксокомплексов. По наклону касательной к кривой в точке перегиба можно определить число ОН-групп, внедряющихся в координационную сферу комплекса. [44]
Таким образом, способностью люминесцировать обладают хлоридные комплексы РЬ и Bi различного состава, интенсивность люминесценции которых также различна. Если люминесценцию РЬС1б - и Bid Смежно зафиксировать при следовых содержаниях в растворе, то люминесценция Pbdra - n п Bid - при л - 5 измерима только в концентрированных растворах. Bid и менее координированных комплексов тех же ионов можно объяснить тем, что у последних возможна дезактивация энергии возбуждения через молекулу воды, включенную в координационную сферу комплекса и связанную посредством водородных связей с молекулами воды, входящими в состав решетки матрицы - льда. С присоединением шестого Ci - в координационную сферу комплекса закрывается последний канал, через который возможна передача энергии возбуждения матрице. [45]
Страницы: 1 2 3 4