Силикатный адсорбент
Cтраница 2
Одним из критериев правильности результатов анализа является материальный баланс распределения элемента в исследуемой схеме эксперимента ( см. с. Приведено распределение V по результатам НАА в компонентах, полученных от деметаллизации нефтяного остатка широкопористым силикатным адсорбентом. Баланс рассчитан с учетом того, что на 1 г адсорбента приходится 0 23 г сырья. [16]
Одним из критериев правильности результатов анализа является материальный баланс распределения элемента в исследуемой схеме эксперимента. На рис. 2 приведено распределение ванадия по результатам НАА в компонентах, полученных от деметаллизации нефтяного остатка широкопористш силикатным адсорбентом. Баланс рассчитан с учетом того, что на I г адсорбента приходится 0 23 г сырья. [17]
При помощи ИК-спектроскопии было показано [16], что адсорбция паров ацетонитрила, хлороформа и аммиака на частично фторированной поверхности силикагеля не приводит к каким-либо изменениям в полосе, соответствующей гидроксильным группам, связанным водородной связью с фтором. Полоса свободных гидроксильных групп при адсорбции на таких силикагелях изменяется так же, как и при адсорбции на обычных силикатных адсорбентах. [18]
Химия силикатов, алюмосиликатов и других близких к ним по структуре тугоплавких окислов выросла в самостоятельное, интенсивно развивающееся направление. Большое развитие получили исследования по изучению гетерогенных равновесий в силикатных иокиспых системах, в том числе при высоких и сверхвысоких давлениях; по кристаллохимии силикатов и алюмосиликатов; по синтезу и изучению строения силикатных адсорбентов и цеолитов ( молекулярные сита); монокристаллов и стекол для создания квантовых генераторов в различных диапазонах электромагнитных колебаний; по разработке методов получения новых силикатных строительных материалов. [19]
Полное сходство в поведении пористого стекла и силикагеля обнаружено также при адсорбции воды, хлороформа, ацетона и фенола в результате спектроскопических измерений в обертонной области [12] и при адсорбции ацетонитрила [13] в области основных частот. На основании этих фактов поверхностям пористого стекла и силикагеля приписывается одинаковая молекулярная структура. В отличие от большинства силикатных адсорбентов, в частности от силикагеля, пористое стекло обладает тем преимуществом, что может быть приготовлено в виде удобной для спектральных измерений пластинки, рассеяние света которой определяется только размерами ее пор. Поскольку размеры пор пористого стекла ( обычно 10 - 50 А) на два-три порядка меньше длины волны света в инфракрасной области, рассеяние незначительно по величине и становится заметным только при работе в ближайшей, обертонной области инфракрасного спектра. [20]
Уменьшение интенсивности полос свободных гидроксилов, сопровождающееся возникновением полос поглощения возмущенных гидроксильных групп, смещенных относительно полос свободных групп ОН в сторону меньших частот, явилось наглядным подтверждением предположения Киселева [15] о том, что поверхностные группы ОН являются теми центрами, к которым присоединяются молекулы при адсорбции. Отсюда следует, что гидроксильные группы поверхности силикатных адсорбентов имеют кислотный характер. Очевидно, при адсорбции эфира его молекула присоединяется к протонизированному атому водорода поверхностной гидроксильной группы своим электроотрицательным атомом кислорода, выступающим в данном случае в роли акцептора протона. Можно считать, что во всех случаях, когда молекула имеет электроотрицательные атомы ( О, N и др.) с неподеленной парой электронов или тт-электроны ( например, молекула бензола), она вступает при адсорбции в квазихимическое донорно-акцепторное взаимодействие с поверхностной группой ОН адсорбента. Это взаимодействие, имеющее квантовоме-ханическое происхождение, заключается в том, что неподеленная пара электронов ( или и-электроны) адсорбированной молекулы смещается в сторону протонизированного атома Н гидроксильной группы поверхности адсорбента. [21]
При адсорбциошю-хроматографическом фракционировании нефтяные ВМС так же, как и при гель-хроматографии, обмениваются металлами с поверхностью адсорбента, в результате суммарное содержание микроэлементов в выделенных продуктах становится неидентичным их концентрации в исходных веществах. Способность к обмену и связыванию различных микроэлементов смолисто-асфальтеновыми веществами должна определяться их химическими свойствами ( функциональным составом) и, следовательно, находиться в связи с химическим типом нефти. Для выяснения характера такой связи нами изучены изменения концентраций микроэлементов в смолах и асфальтенах из западно-сибирских нефтей различных химических типов в процессе их хроматографического разделения на силикатных адсорбентах. [22]
ОН, которым соответствует полоса поглощений 3749 см 1, имеются и такие гидроксильные группы, которые взаимодействуют с соседними гидроксилами. Естественно, что при дегидратации по мере увеличения температуры прокаливания образца пористого стекла с его поверхности в первую очередь удаляются те гидроксилы, которые возмущены взаимодействием друг с другом. Такая интерпретация асимметрии полосы поглощения групп ОН 3749 см 1 находится в полном соответствии с получившими в последнее время распространение представлениями о неравноценности гидроксильных групп на поверхности силикатных адсорбентов. [23]
Вопросам ориентации адсорбированных молекул в поверхностном слое при исследовании адсорбции из растворов до последнего времени уделялось мало внимания. Представления, полученные из данных по строению конденсированных пленок на жидкой поверхности, часто переносились на случай адсорбции на твердых адсорбентах. Последняя, как было показано при изучении адсорбции из паров на силикатных адсорбентах [1], может существенно влиять на адсорбционное равновесие, а следовательно, и на структуру поверхностного слоя. [24]
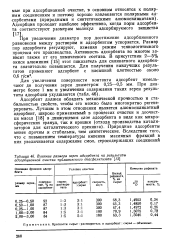 |
Влияние размера зерен адсорбента на результаты адсорбционной очистки туймазинского деасфальтизата. [25] |
При увеличении диаметра пор достижение адсорбционного равновесия между раствором и адсорбентом ускоряется. Размер пор адсорбента регулируют, изменяя режим технологического процесса его производства. Активность адсорбента во многом зависит также от его химического состава. В присутствии 2 - 5 % окиси алюминия [15] этот показатель для силикатного адсорбента значительно повышается. [26]
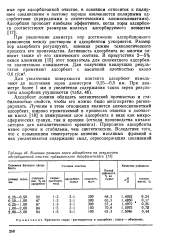 |
Влияние размера зерен адсорбента на результаты адсорбционной очистки туймазинского деасфальтизата. [27] |
При увеличении диаметра пор достижение адсорбционного равновесия между растворам и адсорбентом ускоряется. Размер пор адсорбента регулируют, изменяя режим технологического процесса его производства. Активность адсорбента во многом зависит также от его химического состава. В присутствии 2 - 5 % окиси алюминия [15] этот показатель для силикатного адсорбента значительно повышается. [28]
Однако не вызывает сомнения, что центрами второго рода не могут быть ультрамикропоры или загрязнения поверхности примесями, так как в противном случае трудно было бы объяснить зависимость количества этих центров от температуры предварительной вакуумной тренировки, которая обнаруживается в случае адсорбции хлороформа. Из общепринятых представлений о структуре поверхности пористого стекла следует предположить, что центрами второго рода могут быть атомы кремния или кислорода. Представляется маловероятным, что молекула аммиака, имеющая электроотрицательный атом азота, может присоединяться к электроотрицательному атому кислорода поверхности адсорбента. Более вероятно, что центрами адсорбции для молекулы аммиака служат поверхностные координационно ненасыщенные атомы кремния. Впрочем, вполне возможно, что при адсорбции различных соединений в качестве центров адсорбции второго рода выступают различные молекулярные группы поверхности силикатного адсорбента. [29]
Страницы: 1 2