Валентные возможности
Cтраница 1
Валентные возможности азота ограничены электронной L-оболоч-кой. Другие элементы группы могут использовать для образования связей d - орбитали. [1]
Как изменяются валентные возможности и координационные числа элементов главных подгрупп с ростом заряда ядер их атомов. [2]
В действительности валентные возможности полностью проявляются не у всех элементов второго периода. Нехарактерна валентность четыре для лития, кислорода и фтора. Эти элементы проявляют свои донорно-акцепторные возможности не полностью. Кислород, например, часто проявляет одну из двух возможных донорных валентностей. [3]
Как изменяются валентные возможности и координационные числа элементов главных подгрупп с ростом заряда ядер их атомов. [4]
Это уменьшает валентные возможности первых элементов. [5]
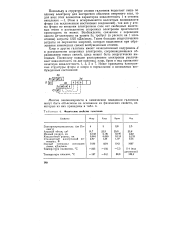 |
Физические свойства галогенов. [6] |
Этим и исчерпываются валентные возможности фтора ( за исключением мостиковых соединений), так как у атома фтора во внешнем электронном слое нет свободных квантовых ячеек и разъединение спаренных электронов практически происходить не может. Возбуждение, связанное с переводом одного 2р - электрона на уровне 3s, требует ( в расчете на 1 моль атомов) затраты 1225 кДж / моль. Такие большие энергетические затраты не окупаются энергией, которая выделяется при образовании химических связей возбужденным атомом. [7]
Таким образом, валентные возможности ЩЭ не слишком разнообразны - это металлическое состояние ( степень окисления 0) и одновалентное состояние ( степень окисления 1), причем из-за относительно низкой величины ПИ ] ионное состояние М именно для ЩЭ наиболее характерно. Поэтому соединения ЩЭ обычно рассматриваются как модельные, когда нужно изучить свойства соединений с преимущественно ионной связью. Для теоретической, да и практической химии ионные соединения, которым присущи, например, высокие температуры плавления и кипения, большая термическая устойчивость, чрезвычайно важны. [8]
Наличие 3йрбиталей атома хлора резко увеличивает валентные возможности и вариации его положительных степеней окисления. Разнообразие валентных состояний и степеней окисления делают химию хлора во многих отношениях отличной от химии фтора. [9]
Наличие 3 / - орбиталей атома хлора резко увеличивает валентные возможности и вариации его положительных степеней окисления. Разнообразие валентных состояний и степеней окисления делают химию хлора во многих отношениях отличной от химии фтора. [10]
Наличие Зс ( - орбиталей атома хлора резко увеличивает валентные возможности и вариации его положительных степеней окисления. [11]
 |
Структура молекулы Р4. Угол между связями в этой молекуле ( 60 значительно меньше прямого угла между атомными р-орбиталями, что делает молекулу Р4 исключительно реакциониоспособной. [12] |
Образование одной связи в молекуле С1 - С1 исчерпывает валентные возможности хлора в простом веществе. В случае серы при конфигурации s2p4 с двумя неспаренными электронами возможно образование нескольких аллотропных модификаций, в том числе и состоящей из бесконечных цепей. Три неспаренных электрона позволяют атомам фосфора связываться в бесконечные плоскости. Такая конфигурация реализуется в красном фосфоре. Кроме того, подобно сере, фосфор существует в форме простого вещества, построенного из небольших замкнутых молекул. [13]
У насыщенных нитрилов - это атом углерода алкильного радикала, валентные возможности которого уже исчерпаны образованием четырех а-связей, и который поэтому не способен ни к я-донорному, ни к я-дативному взаимодействию с цианогруппой нитрила. Напротив, такие возможности появляются у ненасыщенных нитрилов, у родано - и селеноцианат-ионов, в цианидных комплексах металлов. Рассмотрим вначале полученный фактический материал, а затем попытаемся дать его интерпретацию, учитывая указанные особенности строения лигандов. [14]
У многих атомов элементов, особенно у переходных, число не-спареиных электронов и валентные возможности могут увеличиваться при возбуждении. Затраты энергии, необходимой для перевода атома в возбужденное состояние, компенсируются энергией, выделяющейся при образовании химической связи. [15]
Страницы: 1 2 3 4