Валентные возможности
Cтраница 2
Это означает, что из семи электронов внешнего слоя только один остается неспаренным и определяет валентные возможности фтора. Поскольку все остальные орбитали атомов полностью заселены парами электронов, никаких дополнительных возможностей для упрочнения связи в молекуле нет. [16]
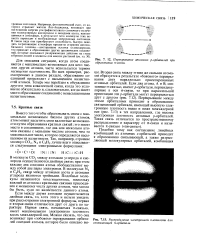 |
Перекрывание атомных р-орбиталей при образовании к-связи.| Распределение электронной плотности для связывающей п-орбитали. [17] |
Вместо того чтобы образовывать связи с максимально возможным числом других атомов, атом может насытить свои валентные возможности путем образования кратных связей; это имеет место в соединениях, где два или несколько атомов связаны с меньшим числом атомов, чем то максимальное число, которое определяется насыщением их валентности. [18]
Углерод ( 1 S22s22p2) может образовать, подобно кремнию, соединение CF4, но при этом валентные возможности углерода будут исчерпаны ( нет неспаренны. [19]
Находится во втором периоде, в главной подгруппе VI группы. Электронное строение атома кислорода и его валентные возможности рассмотрены выше. [20]
Эта электронная формула ничем не хуже и не лучше первой, она просто эквивалентна ей. В обеих электронных формулах правильно учтены валентные возможности всех атомов: все s - и р-под-уровни в валентных оболочках каждого атома полностью заполнены электронами. И все же ни одна из приведенных формул не соответствует действительно наблюдаемым свойствам молекулы. [21]
 |
Диаграмма состояния серы. [22] |
Химия второго типического элемента VI группы - серы - отличается от химии кислорода по меньшей мере двумя аспектами. Во-первых, наличие вакантных 3 -орбиталей увеличивает валентные возможности серы с учетом промотирования электронов на эти орбитали. При этом возрастают и положительные степени окисления серы. Кроме того, создаются условия для дополнительного я-взаимодействия. Наконец, с участием Sd-орбиталей резко возрастает возможное число типов гибридизации, что ведет к увеличению координационного числа серы в ее производных. [23]
Химия второго типического элемента VI группы - серы - отличается от химии кислорода по меньшей мере двумя аспектами. Во-первых, наличие вакантных З - орбиталей увеличивает валентные возможности серы с учетом промотирования электронов на эти орбитали. При этом возрастают и положительные степени окисления серы. Кроме того, создаются условия для дополнительного тг-взаимодействия. Наконец, с участием 3 / - орбиталей резко возрастает возможное число типов гибридизации, что ведет к увеличению координационного числа серы в ее производных. [24]
Химия второго типического элемента VI группы - серы - отличается от химии кислорода по меньшей мере двумя аспектами. Во-первых, наличие вакантных 3 ( йрбиталей увеличивает валентные возможности серы с учетом промотирования электронов на эти орбитали. При этом возрастают и положительные степени окисления серы. Кроме того, создаются условия для дополнительного тг-взаимодействия. Наконец, с участием 3 / - орбиталей резко возрастает возможное число типов гибридизации, что ведет к увеличению координационного числа серы в ее производных. [25]
Координация Со школьной скамья привычно для химика понятие валентности, которая определяет образование и состав веществ. Если исходить из классического представления о валентности, взаимодействие, превышающее валентные возможности, не должно происходить. [26]
 |
Структура икосаэдрической элементарной ячейки бора, В12. В различных аллотропных формах кристаллического бора такие ячейки соединены друг с другом различными способами. [27] |
Атомы металлических элементов, как правило, имеют меньше валентных электронов, чем доступных для заселения орбиталей, другими словами, эти атомы являются электронно-дефицитными. Поэтому такие атомы имеют тенденцию обобществлять электронную плотность с несколькими другими атомами, осуществляя этим способом свои максимальные валентные возможности. В гексагональной плотноупакованной и кубической плотноупако-ванной структурах каждая сфера ( атом) соприкасается с 12 другими сферами, 6 из которых находятся в общей плоскости с данным атомом и еще 3 сверху и 3 снизу от нее. Методом рентгеноструктурного анализа установлено, что приблизительно две трети всех металлов кристаллизуются в одной из этих двух структур. Большая часть металлов из оставшейся трети кристаллизуется с образованием объемно-центрированной кубической структуры, где каждый атом окружен лишь восемью ближайшими соседями. [28]
Такого типа связи играют большую роль в комплексных соединениях, в к-рых центральный атом предоставляет свободные орбиты, а лиганды ( обычно это молекулы с атомами О, N, S) - неподеленные пары электронов. В соединениях мостикового типа, или в соединениях с дефицитом электронов, атомы связаны с большим числом соседей, чем это позволяют валентные возможности. Так, боран ВН3, в к-ром все три валентности бора насыщены, димеризуется с выделением значительной энергии. [29]
Атомы элементов второго периода, к которым принадлежит кислород, не имеют внутренних слоев р-электронов. Отсутствие экрана из р-электронов дает возможность двум атомам кислорода близко подходить друг к другу в результате сильного взаимного проникновения ( лобового перекрывания) облаков валентных р-электронов. Валентные возможности кислорода оказываются исчерпанными. Вместо того, чтобы оставить одну валентность неиспользованной и употребить ее для связи с внешним миром, атом кислорода вполне удовлетворяется взаимодействием внутри молекулы. [30]
Страницы: 1 2 3 4