Адсорбция - атом - водород
Cтраница 1
Адсорбция атома водорода или органического радикала может приводить к заполнению одной из Зй-орбит. [1]
Для адсорбции атома водорода или перехода протона в твердый раствор необходимо предельное сближение между протоном или атомом и активными участками поверхности кристаллов железа. Этой максимальной близостью объясняется то обстоятельство, что наибольшее количество водорода в единицу времени захватывается сталью в процессе ее растворения в кислоте. Непрерывно разрушающаяся решетка кристалла создает на своей поверхности наиболее благоприятные условия контакта протонов и атомов водорода с активными участками решетки. Наоборот, при электролитическом осаждении на катоде железа из раствора, в котором содержится поверхностно-активное вещество ( из добавок хлористого бария), содержание водорода в железе снижается до 2 8 ат. [2]
Субкритический рост трещины включает адсорбцию атомов водорода на свободной поверхности у вершины трещины, поверхностную диффузию водорода, внедрение водорода в кристаллическую решетку и диффузию водорода по кристаллической решетке до некоторой зоны перед вершиной трещины, где и происходит локальное разрушение [180] по достижении критической концентрации водорода в этой зоне. Этой картиной характеризуют разрушение, как правило, высокопрочных сплавов. Для объяснения коррозионного растрескивания под напряжением менее прочных сталей используются представления о возможности ускорения диффузии водорода посредством его переноса дислокациями, приводящего к локальному пересыщению водородом. [3]
Это отношение имеет вид изотермы адсорбции атомов водорода. Однако оно отличается от изотерм, изученных в случае адсорбции на ртутных электродах, поскольку теперь потенциал не является независимой величиной, или, иначе говоря, электрод перестает быть идеально поляризуемым. На рис. 53 показаны некоторые изотермы такого типа Физическая интерпретация этих изотерм не вполне ясна. Поэтому различить эти две модели довольно трудно. Для объяснения наличия двух пиков на псев-доемкостной кривой ( рис. 52) было сделано предположение о существовании двух разных мест адсорбции водорода на платине. [4]
Если исходить из концепции о локализованной адсорбции атомов водорода на стекле и энергию активации процесса принять равной 25 1 ккал / моль, то удается вполне удовлетворительно объяснить экспериментальные значения скорости выделения молекулярного водорода из слоя атомов водорода на стекле при неполном покрытии последнего. [5]
Озани [75] величину перенапряжения объясняет энергией адсорбции атомов водорода, в свою очередь, обусловленной энергией связи атомов металлов и их межатомными расстояниями. [6]
Поскольку при восстановлении кислорода на платине и палладии особая роль отводится адсорбции атомов водорода, а на серебре и ртути - адсорбции анионов 0, изменения состояния поверхности, меняющие адсорбционные характеристики, могут сказываться на кинетике восстановления кислорода. [7]
Адсорбция ионов CN - приводит к резкому уменьшению активных участков поверхности железа, доступных для адсорбции атомов водорода. В результате этого энергия активации процесса возрастает, и скорость наводоро-живания увеличивается. [8]
Влияние поверхностного легирования окиси цинка на адсорбцию I ( I - jb) и рассеяние jbl атомов водорода, 1 1 - адсорбция атомов водорода при легировании ионами цинка и серебра соответственно; 2 2 - рассеянный мишенью пучок атомов водорода при легировании ионами цинка и серебра соответственно. [9]
Хорошо известно, что если ( Л) является определяющей скорость стадией, то энергия активации этой реакции уменьшается с ростом теплоты адсорбции атомов водорода на электроде. Подобное различие обусловлено тем, что в процессе ( В) фигурирует потенциальная энергия состояния перед переходным состоянием; в процессе ( А) выражение для потенциальной энергии характеризует состояние системы после переходного состояния. [10]
Таким образом, по теории замедленного разряда перенапряжение водорода, измеренное на различных металлах при сравнимых условиях, должно закономерно уменьшаться с теплотой адсорбции атомов водорода на поверхности электродного металла. Уравнение ( XV-20), выведенное впервые Фрумкиным, применимо для кислых сред и называется уравнением Фрумкина. [11]
Однако несмотря на то, что затем появилась бесспорно ценная по тем временам работа Н. И. Кобозева и Н. И. Некрасова о влиянии на кинетику разряда иона водорода энергии адсорбции атома водорода на поверхности электрода, это не привело к развитию электрохимической кинетики как самостоятельного направления в науке. В этих работах считалось, что кинетика электрохимических процессов обусловлена не электрохими-ской, а некоторой химической стадией, которая входит как звено в суммарный процесс. Это была, в представлении Тафеля, а отчасти и у Кобозева и Некрасова, рекомбинация двух атомов с образованием молекулы водорода. В первоначальной формулировке это представление не приводило к правильному значению коэффициента перед логарифмом плотности тока в уравнении Тафеля, но длительное время других объяснений не было, и нельзя было говорить об электрохимической кинетике, так как в кинетике электрохимических реакций не видели ничего специфически электрохимического. [12]
Вероятно, столь аномально проявившееся влияние частоты на-гружения 0 1 Гц на кинетическую диаграмму усталостного разрушения стали 45ХН2МФА ( см. рис. 5.47) обусловлено образованием защитной пленки, затрудняющей адсорбцию атомов водорода в окрестности вершины трещины. В результате снижается степень водородного охрупчивания границ зерен и соответственно уменьшается скорость роста трещины в припороговой области. Ослабление водородного охрупчивания фрактографически проявляется в уменьшении доли межзеренного разрушения и снижении степени ветвления трещин по границам зерен. [13]
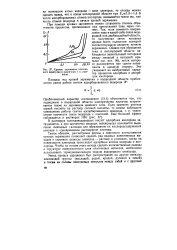 |
Кривые заряжения платино - УКЯЧЫВЯРТ ня нрпбпятимый хяпяк-вого электрода в различных 1 н. раст - Указывает на неооратимыи харак-ворах тер процессов адсорбции и десорб. [14] |
Таким образом, рассмотрение формы и взаимного расположения кривых заряжения позволяет сделать ряд важных качественных выводов о строении границы электрод - раствор в условиях, когда на поверхности электрода происходит адсорбция атомов водорода и кислорода. Чтобы на основе этого метода сделать количественные выводы о структуре поверхностного слоя платиновых металлов, необходимо использовать термодинамическую теорию водородного электрода. [15]
Страницы: 1 2 3