Адсорбция - нейтральная молекула
Cтраница 2
Адсорбция из растворов является основным методом извлечения примесей и очистки жидкостей. Различают адсорбцию нейтральных молекул ( неэлектролитов), ионов ( электролитов) и коллоидных частиц. Ниже дается краткое описание первых двух адсорбции, а адсорбция коллоидных частиц рассматривается при изучении устойчивости дисперсных систем. [16]
Сначала рассматривается случай, когда адсорбирующаяся частица не участвует в реакции. Основной эффект при адсорбции посторонних нейтральных молекул проявляется в снижении скорости процесса. Относящиеся к этому случаю наблюдения качественного характера из области полярографии, действия ингибиторов и электроосаждения металлов слишком многочисленны, чтобы их можно было охватить в настоящей работе. Следует остановиться только на некоторых вопросах. [17]
Необходимо отметить, что образование на поверхности платины при. Это изменяет характер адсорбции нейтральных молекул и заряженных частиц. [18]
Парсонс считает [1], что в качестве электрической переменной при изучении изотерм адсорбции следует выбирать заряд, а не потенциал электрода. Обоснование этого утверждения для случая адсорбции нейтральных молекул из растворов, содержащих высокую концентрацию индифферентного электролита, вызывает сомнение. [19]
Поэтому с ростом концентрации вещества в объеме адсорбция нейтральных молекул быстро обгоняет адсорбцию ионов, что хорошо подтверждается экспериментом. [20]
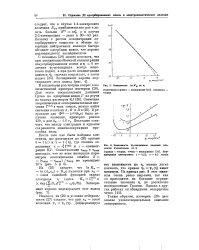 |
Зависимость In Кл от 1.| Зависимость ЧЧ-потенциала внешней плоскости Гслыигольца от г. [21] |
Ваа приблизительно раз в десять больше j3 ( s) ЯТ-Q, а в случае 2 - 2-электролита - даже в 30 - 40 раз. Поэтому с ростом концентрации адсорбируемого вещества в объеме адсорбция нейтральных молекул быстро обгоняет адсорбцию ионов, что хорошо подтверждается экспериментом. [22]
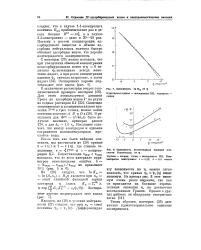 |
Зависимость In Ka от 1.| Зависимость i-потенцяала внешней плоскости Гельмгольца от ч. [23] |
Ваа приблизительно раз в десять больше S ( s) лго, а в случае 2 - 2-электролита - даже в 30 - 40 раз. Поэтому с ростом концентрации адсорбируемого вещества в объеме адсорбция нейтральных молекул быстро обгоняет адсорбцию ионов, что хорошо подтверждается экспериментом. [24]
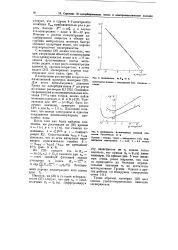 |
Зависимость Ш Л а от t. [25] |
Ваа приблизительно раз в десять больше J5 ( s) я / о, а в случае 2 - 2-электролита - даже в 30 - 40 раз. Поэтому с ростом концентрации адсорбируемого вещества в объеме адсорбция нейтральных молекул быстро обгоняет адсорбцию ионов, что хорошо подтверждается экспериментом. [26]
Существующие методы определения адсорбции на металлах показывают, что последняя существенно зависит от потенциала или, точнее, от величины и знака заряда поверхности металла. Так, из электрокапиллярных кривых известно, что адсорбция нейтральных молекул органического вещества происходит лишь в интервале потенциалов, близких к электрокапиллярному максимуму. Появление и исчезновение адсорбированного слоя происходит в очень узком интервале потенциалов так, что на электрокапиллярной кривой образуются острые углы. С увеличением числа атомов углерода в молекуле эффект этот проявляется более резко. [27]
Если у 0, то поверхность металла заряжена положительно и на ней будут адсорбироваться преимущественно анионы. При 0 происходит адсорбция катионов и при 0 - адсорбция нейтральных молекул. Рассмотрим с эти-х позиций влияние ПАВ на процессы цементации меди железом. [28]
Адсорбция поверхностно-активных молекул на поверхности раздела является, как известно, процессом самопроизвольным, приводящим к понижению запаса свободной энергии системы поверхность раздела раствор поверхностно-активного вещества. Было замечено, что заряды, находящиеся на поверхности раздела, препятствуют адсорбции нейтральных молекул поверхностно-активных веществ. [29]
Поэтому в области очень малых степеней заполнения, когда члены с Fa ( S) в показателе экспоненты в ( 46) не играют роли, специфическая адсорбция ионов на металлическом электроде должна идти интенсивнее, чем адсорбция нейтральных молекул; наоборот, на диэлектрическом электроде картина должна быть обратной. Так как I a ( im) ( M - йа2, то эффект должен резко возрастать с валентностью ионов. Именно этим, по всей вероятности, и объясняется сильная адсорбируемость поливалентных ионов в разбавленных растворах. [30]
Страницы: 1 2 3