Адсорбция - продукт - реакция
Cтраница 3
 |
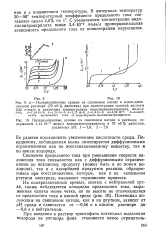
Кинетические кривые расходования а-пинена при каталитической изомеризации. [31] |
Постоянная концентрация пинена на поверхности катализатора может быть лишь в случае, если адсорбция пинена поверхностью катализатора во много раз превосходит адсорбцию продуктов реакции, которые по мере своего образования немедленно вытесняются с поверхности, и достаточно хорошего массо-обмена в системе, обеспечивающего необходимый приток пинена к поверхности катализатора. [32]
Другое возможное истолкование физического смысла члена А относится и случаю реакции на частично заполненной поверхности, когда этот член учитывает убыль энергии адсорбции продукта реакции по мере заполнения поверхности. Такая трактовка вопроса была впервые дана в работе Л. Н. Фрумиина и II. [33]
 |
Поляризационные кривые на свинцовом катоде в растворе, содержащем ( 1 14 - 10 - 2 моль / л индолилнитроакрилата и 70 об. % диоксана, различных рН. 1 - 1 0. 2 - 7 0. [34] |
Снижение предельного тока при уменьшении скорости наложения тока связывается как с диффузионными ограничениями по исходному продукту ( может быть и по ионам водорода), так и с адсорбцией продуктов реакции, образующихся при восстановлении, которые, как и на капельном ртутном электроде, вызывают торможение процесса. [35]
Qn - Величина у в общем случае зависит от теплот адсорбции частиц, присутствующих на поверхности, и от энергии активации Е в том случае, когда заполнение поверхности меняется вследствие адсорбции продуктов реакции. [36]
Брдичка впервые предположил, что появление подобных волн обусловлено адсорбционными явлениями и развил соответствующую теорию, согласно которой появление адсорбционной пред-волны обусловлено облегчением протекания обратимого электродного процесса в результате выигрыша энергии при адсорбции продуктов реакции, и поэтому она предшествует основному электродному процессу, потенциал полуволны которого близок для обратимой системы к окислительно-восстановительному потенциалу системы. Наоборот, адсорбция реагента затрудняет разряд, в связи с чем процесс с участием адсорбированного вещества О протекает при более отрицательных потенциалах, чем потенциал полуволны обратимой окислительно-восстановительной системы. [37]
С ростом величины органической молекулы повышается ее адсорбируемость на ртутном электроде ( при не очень отрицательных значениях потенциала); поэтому более высокая адсорбируемость продуктов реакции по сравнению с адсорбцией исходных веществ должна наблюдаться у электродных процессов, приводящих к образованию димеров. Влияние адсорбции продуктов реакции на электродный процесс особенно удобно проследить для случая, когда перенос электронов происходит настолько быстро, что электрохимическую стадию мбжно рассматривать как обратимую или почти обратимую. [38]
Следует отметить, что k0 и k0 являются постоянными только в случае незаряженных поверхностно-активных веществ, в противном случае k0 и ko будут функциями заполнения поверхности. Влияние адсорбции продуктов реакции на скорость электродных процессов аналогично действию электрохимически неактивных веществ. [39]
С ростом величины органической молекулы повышается ее адсорбируемость на ртутном электроде ( при не очень отрицательных значениях потенциала); поэтому более высокая адсорбируемость продуктов реакции по сравнению с адсорбцией исходных веществ должна наблюдаться у электродных процессов, приводящих к образованию димеров. Влияние адсорбции продуктов реакции на электродный процесс особенно удобно проследить для случая, когда перенос электронов происходит настолько быстро, что электрохимическую стадию можно рассматривать как обратимую или почти обратимую. [40]
Исследовано полярографическое поведение катиона тропипия на капельном ртутном электроде в водно-этаноловых растворах. Показано, что влияние адсорбции продукта реакции - дитропила сильно ослабляется при увеличении концентрации этанола в растворе вследствие увеличения взаимодействия между дитропилом и растворителем, а не вытеснения дитропила с поверхности электрода адсорбирующимся этанолом. [41]
Митшка и Шнейдер [222] рассматривали реакцию с такой же кинетикой для случая, когда в уравнении (IV.4) константа скорости определяется выражением k KA. Принимается, что константа адсорбции для реагента А велика, а константы адсорбции продуктов реакции пренебрежимо малы. Влияние температуры на k и К описывается уравнением Аррениуса. Так как адсорбционные константы уменьшаются с температурой, то применительно к экзотермическим реакциям делается интересный вывод. Согласно последнему торможение, обусловленное адсорбцией реагентов, уменьшается с увеличением градиента температуры. [42]
Судя по потенциометрическим данным, первая стадия реакции ( до поглощения 0 6 моля Н2) лимитируется активацией водорода на поверхности катализаторов, а последующая - активацией непредельного соединения. К концу реакции устанавливается исходное значение потенциала, что свидетельствует об отсутствии адсорбции продуктов реакции. [43]
Если дело обстоит таким образом, то г - 0 и ДАЯ - приблизительно постоянная величина, и тогда скорость реакции не зависит от заполнения. Если предполагается активированная адсорбция, то на первой стадии реакции г представляет только изменение теплоты адсорбции продуктов реакции и скорость реакции будет зависеть от заполнения. [44]
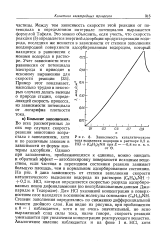 |
Зависимость каталитического тока выделения водорода в растворе 0 2 н. НС1 ( С6Н6 2МН при Е - 0 8 по н. к. э. от в. [45] |
Страницы: 1 2 3 4 5