Адсорбция - реагент
Cтраница 1
Адсорбция реагента на породе имеет большое практическое значение. [1]
Адсорбция реагентов происходит, в первую очередь, на активных центрах. Скорость гетерогенно-каталитической реакции зависит не только от концентрации компонентов в газовой фазе, но и от их адсорбционного равновесия на поверхности катализатора. Поскольку продукты - реакции занимают часть активных центров, то они тормозят реакцию. [2]
Вначале происходит адсорбция реагента поверхностью. Молекулы среды заполняют микротрещины, появившиеся в ходе вытягивания и при текстильной переработке волокон. Под влиянием электростатического поля на катионах металлов поверхностного слоя образуются оболочки из молекул реагента, ориентированные к ним отрицательными концами диполей. Связь между каркасом кремнекислого аниона и катионами ослабевает, и происходит переход катионов в раствор. [3]
В результате адсорбции реагентов на поверхности катализатора, концентрация компонентов столкновения увеличивается, что повышает скорость химической реакции. При адсорбции на поверхности катализатора часто происходит ослабление связей в молекулах реагирующих веществ, что приводит к повышению их активности. Примером гетерогенной каталитической реакции может быть окисление сернистого газа кислородом в присутствии платины или V Oc. Слабым катализатором этого процесса является также РеоОз. Поэтому при сжигании серы на железной ложечке, кроме бесцветного сернистого газа, появляется белый дымок серного ангидрида. [4]
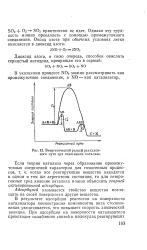 |
Энергетический рельеф реакционного пути при гомогенном катализе. [5] |
В результате адсорбции реагентов на поверхности катализатора концентрация компонентов акта столкновения увеличивается, что повышает скорость химической реакции. [6]
В результате адсорбции реагента гидроксидом магния Mg ( OH) 2 осадок приобретает характерную синюю окраску. [7]
В некоторых случаях адсорбция реагентов может происходить на разных активных центрах, и тогда конкуренция за них возникает лишь между веществами, способными адсорбироваться на этих центрах. [8]
В некоторых случаях адсорбция реагентов и продуктов может происходить на разных центрах, например, А, и Bt сорбируются на центрах одного типа, а А2 и В2 - на центрах другого типа. [9]
На основании известных величин адсорбции реагентов можно судить о том, какая из этих двух величин является более вероятной. [10]
Протекание гетерогенных реакций зависит от адсорбции реагентов поверхностью катализатора, для чего необходимо соприкосновение газов или паров с контактом в течение некоторого времени. Длительность соприкосновения играет большую роль в гетерогенном катализе, почему ее надо учитывать для регулирования и воспроизведения реакций. [11]
Важную роль в катализе играет адсорбция реагентов на поверхности контакта. На металлах кислород адсорбируется очень быстро, затем идет более медленный процесс его проникания в приповерхностный слой. У серебряного катализатора происходит глубокое изменение свойств приповерхностного слоя. В случае неблагородных металлов при адсорбции на них кислорода образуются оксиды. Адсорбция углеводородов на металлах является обратимой, образующиеся связи непрочны. Более сильна адсорбция на оксидах, активными центрами которых являются ионы переходных металлов. [12]
Протекание гетерогенных реакций зависит от адсорбции реагентов поверхностью катализатора, для чего необходимо соприкосновение газов или паров с контактом в течение некоторого времени. [13]
Протекание гетерогенных реакций зависит от адсорбции реагентов поверхностью катализатора, для чего необходимо соприкосновение газов или-паров с контактом в течение некоторого времени. Длительность соприкосновения играет большую роль в гетерогенном катализе, почему ее надо учитывать для регулирования и воспроизведения реакций. [14]
Основные составляющие поляризации определяются процессами адсорбции реагентов на поверхности электрода, переносом электронов и поверхностными реакциями. Большое влияние на кинетику оказывает двойной слой, образующийся на границе электрод ( металл) - электролит. [15]
Страницы: 1 2 3 4