Адсорбция - электролит
Cтраница 3
Специфичность адсорбции электролитов состоит в том, что на поверхности данного адсорбента адсорбируются преимущественно катионы или анионы. Основные факторы, обусловливающие специфичность адсорбции электролитов, характеризуются знаком заряда поверхности адсорбента, валентностью ионов, величиной их радиуса и степенью сольватации. [31]
На адсорбцию электролитов основное влияние оказывает природа ионов. Ионы одинаковой валентности адсорбируются тем лучше, чем больше их радиус. [32]
Что касается адсорбции электролитов из водных растворов на твердых адсорбентах, то в дальнейшем мы будем интересоваться только полярными ( гетерополярными) адсорбентами, так как на неполярных ( гомополярных) адсорбентах электролиты, как правило, либо совсем не адсорбируются, либо адсорбируются весьма слабо. Таковым, например, является предельно обеззо-ленный и обезгаженный уголь. [33]
Обращаясь к адсорбции электролитов на твердых гетерополяр-ных адсорбентах, необходимо отметить, что она лишь в немногих случаях имеет молекулярный характер, когда и катион и анион электролита адсорбируются в одинаковой мере; при этом она мало отличается от рассмотренного случая адсорбции неэлектролитов и. Типичными чертами адсорбции сильных электролитов являются ее избирательность и обменный характер. [34]
Важное значение имеет адсорбция электролитов на твердых адсорбентах при очистке растворов от различных радиоактивных элементов. [35]
Что же касается адсорбции электролитов, то здесь имеется немало противоречий, которые объясняются наличием как молекулярной, так и ионообменной сорбции. Слабокислотный характер функциональных групп силикагеля определяет его сорбционные свойства в водных растворах. Замещение водорода в поверхностных ОН-груп-пах ионами металлов наблюдается в заметных количествах только в щелочных растворах. Поэтому силикагель хороню поглощает щелочи, адсорбционная емкость изменяется в ряду LiOHNaOHK. При контакте силикагеля с солями щелочных и щелочноземельных металлов наблюдается иодкисле-пие раствора. [36]
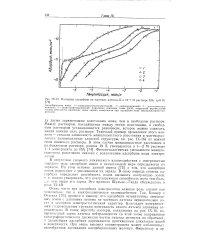 |
Х-12 Изотермы адсорбции на частицах латекса - G в 10 - 3 М растворе КВг ( рН 8. [37] |
Очень часто при адсорбции электролитов важную роль играют как химическое, так и электрохимическое взаимодействие. Так, Коннор и Оттевил [76] пришли к выводу, что адсорбция четвертичных аммониевых ионов с длинными цепями на частицах латекса первоначально носит в основном электростатический характер. Благодаря поверхностным гпдроксильным группам поверхность самого латекса заряжена отрицательно. В точке перегиба изотерм, показанных на рис. IX-12, поверхностный заряд латекса нейтрализуется ( в этой точке направление электрофоретического движения частиц латекса меняется на обратное), и дальнейшая адсорбция определяется притяжением алкильных цепей к поверхности. При очень высоких концентрациях может наблюдатьс; своеобразная ассоциация адсорбированных молекул. [38]
Наиболее характерными особенностями адсорбции электролитов на поверхности твердых адсорбентов являются ее специфичность ( избирательность) и обменный характер. [39]
Электрофорез также объясняется адсорбцией электролитов и возникновением двойных слоев на границе двух фаз. Таким образом, следует признать, что адсорбция, например, катионов на частицах делает их положительными, а смачивающие их слои жидкости - отрицательными за счет ориентированных анионов: или, наоборот, анионы адсорбируются коллоидными частицами, катионы же остаются в жидкости. [40]
Оказалось, что при адсорбции электролитов скорость определяется величиной коэффициентов диффузии коионов. Интересно указать, что иониты могут растворять труднорастворимые осадки, вступающие в контакт с зернами ионита. Кинетика такой трехфазной системы пока не разработана, но выяснено влияние некоторых факторов на скорость растворения осадка. [41]
Петика показал, что адсорбция поверхностноактивных электролитов на поверхности раздела вода - воздух не может быть рассчитана по данным поверхностного натяжения при помощи уравнения Гиббса, за исключением тех случаев, когда в растворе присутствует избыток нейтрального электролита. В отсутствие нейтральной соли для оценки адсорбции из растворов простых ионо-генных ПАВ необходимо принять ряд допущений нетермодинамического характера. По данным межфазного натяжения он рассчитал поверхностный избыток по уравнению ( 108) в отсутствие нейтральной соли и показал, что вычисленные величины совпадают с экспериментальными значениями. [42]
Избирательный и обменный характер адсорбции электролитов играет основную роль в различных процессах, совершающихся в коллоидных растворах, в частности в процессах, связанных с их строением и зарядом. [43]
 |
Гидрофобизация поверхности. [44] |
Обычно различают три основных типа адсорбции электролита: 1) эквивалентная адсорбция; 2) обменная адсорбция; 3) специфическая ( избирательная) адсорбция. [45]
Страницы: 1 2 3