Возможность - образование - водородная связь
Cтраница 2
Для предсказания возможности образования водородной связи в циклических гликолях и ее относительной прочности е-обходимо учитывать взаимное пространственное расположение гидроксильных групп в различных конформациях. Внутримолекулярную водородную связь в гликолях удобно изучать с помощью ИК-спектроскопии. Обычно используются очень разбавленные растворы в четыреххлористом углероде, чтобы избежать образования межмолекулярных водородных связей. [16]
Приведенные данные показывают возможность образования водородных связей в молекуле. Так, потенциал восстановления самого флаванола равен 1 33 в, введение оксигрупп в положение 5 ( у апигенина, лютеолина или глюкозида кверцитина) резко повышает потенциал, что можно объяснить образованием прочной водородной связи. Метилирование оксигрупп кверцитина в положениях 5, 7, 3 и 4 приводит к сильному снижению значения потенциала восстановления полуволны ( до - 1 47), полное ацети-лирование кверцитина уменьшает полуволновый потенциал до - Г, 16, что объясняется исчезновением водородной связи. [17]
Таким образом появляется возможность образования водородных связей гидроксильных групп, возникших в исходном полимере вследствие дегидрохлорщювания и окисления, [ б, с. [18]
Это тесно связано с возможностью образования водородных связей, способствующих параллелизации волокон и возникновению больших сил притяжения между соседними макромолекулами полимера. В результате элементарные волокна или полимерные молекулы выпрямляются и тесно прилегают друг к другу, образуя плотную и прочную нить. Предполагают также, что водородные связи сшивают нитевидные молекулы. [19]
Существенное осложняющее влияние вносит и возможность образования водородных связей. Однако в большей части случаев расчеты по аддитивным схемам обеспечивают получение результатов, близких по точности к экспериментальным. [20]
На ашгезоне, который исключает возможность образования водородных связей, мстилцпклогоксанолы на стереоизомеры пе разделяются. [21]
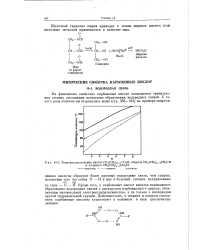 |
Температуры кипения кислот СН3 ( СН2 2 С02Н, спиртов СН3 ( СН2 П 2СН2ОН. [22] |
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной злектроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров. [23]
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров. [24]
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карболовые кислоты существуют в основном в виде циклических димеров. [25]
Отсутствие амид-ной группировки в этом сульфоне исключает возможность образования водородной связи. [26]
Можно полагать, что эта особенность определяется возможностью образования дополнительных водородных связей, о которой говорилось выше. [27]
На физические свойства кислот очень сильное влияние оказывает возможность образования водородных связей. С, кислоты смешиваются с водой в любых соотношениях. [28]
Несомненно, в жидкой фазе существенную роль играет возможность образования водородных связей и донорно-акцепторных комплексов, время образования которых изменяется в зависимости от конкретного случая. [29]
Может быть, здесь играет роль различие в возможностях образования водородных связей ионом NHJ. [30]
Страницы: 1 2 3 4