Специфическая адсорбция
Cтраница 2
Специфическая адсорбция наблюдается в условиях, которые определяются индивидуальной химической природой адсорбента и адсорбируемого электролита. [16]
Специфическая адсорбция их происходит с участием неподеленной электронной пары атома серы. Сильное адсорбционное взаимодействие, близкое к хемосорбционному, приводит к образованию плотных адсорбционных слоев и экранированию металла. [17]
Специфическая адсорбция, приводящая к локализации, ослаблению или усилению взаимодействия G / Я, может влиять как на ел, так и на А, и, соответственно, на значения молекулярных площадок в монослое для любого адсорбата, включая азот. [18]
Специфическая адсорбция более избирательна, чем неспецифическая, и зависит как от свойств сорбируемых ионов, так и от природы поверхностных функциональных групп, поэтому тяжелые металлы энергично адсорбируются почвами из растворов. Механизм специфического поглощения более свойствен свинцу, чем цинку и кадмию. [19]
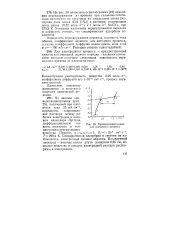 |
Хронопотенциограмма для изучаемого процесса. [20] |
Специфическая адсорбция в системе не наблюдается, электродный процесс обратим. Исследуемый электрод - висячая капля ртути радиусом 0 05 см, исходное вещество и продукт электродной реакции растворимы в электролите. [21]
Специфическая адсорбция может происходить как в результате химического взаимодействия, так и в результате действия сил Ван-дер - Ваальса. [22]
Специфическая адсорбция ионов или дипольных молекул приводит, в свою очередь, к изменению соотношения между полным падением потенциала а границе электрод - расг-вор и - потенциалом. [23]
Специфическая адсорбция ионов должна влиять не только на выделение кислорода, но и на другие процессы, если только образуется хемосорбированная пленка; однако в настоящее время такие данные отсутствуют. [24]
Специфическая адсорбция галогенид-ионов общеизвестна. Она наблюдается для большинства металлов и так же, как и для ртути, отражает наличие некоторого химического взаимодействия. В достаточно концентрированных растворах адсорбционные потенциалы в присутствии анионов С1 - и Вг - достигают высоких значений и на границе с воздухом. [25]
Специфическая адсорбция ионов не оказывает влияния на скорость безактивационной ионизации, поскольку последняя при pv 0 не зависит от строения двойного электрического слоя. В случае же обычного разряда изменение г / - потенциала при адсорбции, например, иода приводит к двум противоположным эффектам - снижению скорости разряда и увеличению приэлек-тродной концентрации ионов водорода, участвующих в процессе. Как следует из рис. 7 4, первый эффект преобладает. Это происходит, в частности, потому, что в реакции электрохимической десорбции принимают участие молекулы воды. [26]
Очевидно специфическая адсорбция зависит не только от адсорбирующегося иона, но и от химического состава и структуры поверхности, на которой он адсорбируется, что может служить в некоторых случаях основанием для предварительного суждения о подборе электролита. [27]
Подобная специфическая адсорбция, конечно, может оказать влияние на кинетику электродных процессов, и это необходимо учитывать при вычислении Rct для рассматриваемой реакции. В случае чисто химической реакции также необходимо иметь в виду специфическую адсорбцию, вводя аналогичные адсорбционные емкости. Кроме того, может оказаться необходимым включить сопротивление между вводами соответствующих длинных линий, чтобы принять во внимание изменение кинетики реакции в плоскости, совпадающей с поверхностью электрода. [28]
Специфическая адсорбция реагентов и веществ, непосредственно в реакции не участвующих, значительно осложняет наблюдаемые закономерности. [29]
Специфическая адсорбция галоидов во всех случаях отражает наличие некоторого химического взаимодействия аниона с поверхностью металла. Однако не следует переоценивать роль этого химического взаимодействия в случае адсорбции ионов хлора или брома на ртути, по крайней мере, если предположить, что электрокапиллярные измерения дают исчерпывающее представление об этой адсорбции. [30]
Страницы: 1 2 3 4