Специфическая адсорбция
Cтраница 3
Специфическая адсорбция многозарядных катионов, таких как А1, ре, может привести к перезарядке поверхности. При отсутствии зарядов в области низких рН стабильность золей обусловлена наличием гидратных оболочек, препятствующих агрегированию частиц между собой. [31]
Специфическая адсорбция газовых ионов на частицах аэрозолей значительно осложняет оценку зарядов частиц. Она характерна для частиц, имеющих химическое сродство к газовым ионам, или для систем, в которых межфазный потенциал возникает еще при их образовании. Электрический потенциал на межфазной границе может возникнуть при условии резко выраженного различия полярных свойств среды и дисперсной фазы. Примером могут служить аэрозоли воды или снега; ориентация молекул воды на поверхности частиц по оценке А. Н. Фрумкина обусловливает электрический потенциал около 0 25 В и их положительный заряд. Электрический заряд на частицах может возникнуть и в процессе диспергирования ( баллоэлектризации) полярных веществ, когда частицы, отрываясь, захватывают заряд с поверхности макротела. Химическое сродство частиц к ионам и возникший потенциал на межфазной границе приводят к тому, что частицы аэрозоля неодинаково адсорбируют противоположно заряженные ионы, и средний их заряд в системе отличен от нуля. Опытным путем установлено, что частицы аэрозолей металлов и их оксидов обычно приобретают отрицательный заряд, а неметаллы и их оксиды заряжаются, как правило, положительно. [32]
Специфическая адсорбция ионов Cs, по-видимому, происходит сильнее из диметилформамида, чем из формамида и N-метилформамида. CsCl ( при - 1 6 В относительно водного НКЭ), сообщенного Дамаскиным и Ивановой [7] для N-метилформамида. Это подтверждается измерениями емкости [46] для растворов Csl ( рис. 22), где обнаруживаются резкое возрастание емкости и сильная концентрационная зависимость в катодной области. Кривые для LiCl ( рис. 23), напротив, совершенно плоские и почти не зависят от концентрации. [33]
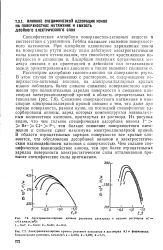 |
Электрокапилляриые кривые ртутного электрода в растворах KI в формамнде. [34] |
Специфическая адсорбция поверхностно-активных веществ в соответствии с уравнением Гнббса вызывает снижение поверхностного натяжения. [35]
Подобная вынужденная специфическая адсорбция не сопровождается образованием прочной химической связи между мо-стиковым лигандом и электродом. [36]
Специфическая адсорбция ионов цинка на поверхности платины существенно изменяет энергетическое состояние водорода. Увеличивается концентрация слабосвязанного водорода при 0 12 б, который вследствие небольшой энергии связи может быть адсорбированным только в виде молекул. Концентрация атомарного водорода со средней энергией связи уменьшается, так как, видимо, адсорбция цинка в первую очередь идет на центрах со средней активностью. Значительная величина максимума при 0 30 в может определяться как водородом с максимальной энергией связи, так и десорбцией цинка с поверхности платины. [37]
Специфическая адсорбция газовых ионов па частицах аэрозолей значительно осложняет оценку зарядов частиц. Такая адсорбция характерна для частиц, имеющих химическое сродство к газовым ионам, или для систем, в которых электрический потенциал на межфазной границе возникает еще при их образовании. Межфазный потенциал может возникнуть при условии резко выраженного различия полярных свойств среды и дисперсной фазы. Примером могут служить аэрозоли воды и снега; ориентация молекул воды на поверхности частиц по оценке А. Н. Фрумкина обусловливает электрический потенциал около 0 25 В. [38]
Специфическая адсорбция изотиоцианатных комплексов Сг ( III), содержащих координированные через азот тиоцианат-ионы, осуществляется через атомы серы, которые непосредственно взаимодействуют с атомами ртути на поверхности электрода. Адсорбируемость изотиоцианатных комплексов Сг ( III) при прочих равных условиях возрастает с увеличением числа внутрисферных тиоцианат-ионов. Для комплексов Cr ( H2O) 8 ( NCS), [283, 319] и Cr ( NCS) jj - [321] предельные заполнения поверхности Тх достигаются при объемных концентрациях указанных комплексов 10 - 4 М [ Г 2 - 10 - 10 моль-схг. [39]
Такая специфическая адсорбция описывается уравнением Ленгмюра. Согласно Эгертону и Стоуну [91], модель Ленгмюра дает самосогласующееся описание специфической адсорбции СО на цеолите CaY. Первые 15 ионов кальция занимают места S недоступные для молекул окиси углерода. Таким образом, из-за различного положения катионов в некоторых цеолитных структурах ( например, в цеолите типа Y) сам факт ионного обмена еще не обязательно должен изменять специфичность адсорбции. Во многих случаях обменные катионы могут располагаться в недоступных местах структуры и не оказывать заметного влияния на селективность адсорбции. [40]
 |
Схема, поясняющая перемену знака - потенциала. [41] |
Такая специфическая адсорбция связана с поляризуемостью данного иона или с поляризацией ионов или молекул, находящихся на поверхности. На рис. 107 приведена схема, поясняющая перемену знака электрокинетического потенциала. Граница скольжения между связанными и свободными противоиона-ми обозначена АВ. Кривая падения термодинамического потенциала abc отсекает на линии АВ некоторый отрезок, расположенный под осью абсцисс. Это отвечает отрицательному значению - потенциала. О, и частицы с таким зарядом переносятся к аноду. Кривая ас на рис. 107 показывает изменение термодинамического потенциала до перезарядки. Здесь - потенциал имеет положительное значение. [42]
Если специфическая адсорбция ионов на поверхности электрода является обратимой, то форма спектров AR / R0 - Я при этом обычно не изменяете, а изменение кривых AR / RQ - Е0 при Х const может быть связано с соответствующим изменением емкости. Поэтому сильное искажение спектров электроотражения может служить указанием на образование химических соединений. Такие данные были получены в водных растворах KI при больших анодных потенциалах серебряного и золотого электродов. [43]
При специфической адсорбции z T z - T - 4Q изменяется потенциал и возрастают обе емкости. [44]
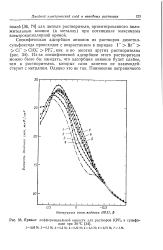 |
Кривые дифференциальной емкости для растворов KPF6 в сульфо. [45] |
Страницы: 1 2 3 4