Специфическая адсорбция - анион
Cтраница 1
Специфическая адсорбция анионов оказывает влияние на кинетические характеристики водородного электрода по следующим причинам: а) изменяется р2 - потенциал ( во внешней плоскости); б) изменяется стандартная свободная энергия адсорбции водорода ( рис. 132); в) блокируется часть поверхности. [1]
Специфическая адсорбция анионов вызывает сдвиг п.н.э. в отрицательную сторону, а катионов - в положительную сторону. При уменьшении концентрации специфически адсорбирующихся ионов п.н.э. стремится к нулевой точке. При этом предполагается, что соли КА и КА, которым соответствуют кривые / - 2 и / - 2 ( рис. 3.5), имеют общий катион и одинаковую концентрацию. [2]
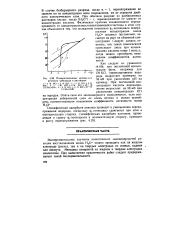 |
Поляризационные кривые дли ртутного электрода в растворах. [3] |
Специфическая адсорбция анионов приводит к уменьшению перенапряжения водорода, поскольку - потенциал сдвигается при этом в отрицательную сторону. [4]
 |
Строение двойного электрического слоя. [5] |
В случае значительной специфической адсорбции анионов отрицательная величина / - потенциала может быть весьма значительной; в концентрированных растворах электролитов она в ряде случаев достигает нескольких десятых вольта даже тогда, когда двойной электрический слой не имеет диффузного строения. [6]
Наиболее обстоятельно роль предварительной специфической адсорбции аниона была показана радиохимическим методом ( стр. [7]
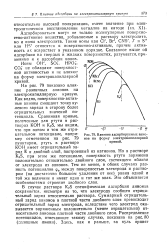 |
Влияние адсорбируемых анио. [8] |
В случае раствора KjS специфическая адсорбция анионов сохраняется, несмотря на то, что электроду сообщен отрицательный заряд относительно раствора. Суммарный отрицательный заряд анионов в плотной части двойного слоя превосходит отрицательный заряд электрода, вследствие чего электрод оказывается заряженным положительно ( менее отрицательно) относительно анионов плотной части двойного слоя. [9]
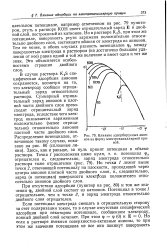 |
Влияние адсорбируемых анионов на форму электрокапиллярной кривой. [10] |
В случае раствора K2S специфическая адсорбция анионов сохраняется, несмотря на то, что электроду сообщен отрицательный заряд относительно раствора. Суммарный отрицательный заряд анионов в плотной части двойного слоя превосходит отрицательный заряд электрода, вследствие чего электрод оказывается заряженным положительно ( менее отрицательно) относительно анионов плотной части двойного слоя. [11]
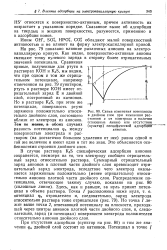 |
Схема изменения потенциала в двойном слое при изменении расстояния х от электрода и наличии ( сплошные линии или отсутствии ( пунктир специфической адсорбЩЙ анионов. [12] |
В случае раствора К2 специфическая адсорбция анионов сохраняется, несмотря на то, что электроду сообщен отрицательный заряд относительно раствора. Суммарный отрицательный заряд анионов в плотной части двойного слоя превосходит отрицательный заряд электрода, вследствие чего электрод оказывается заряженным положительно ( менее отрицательно) относительно анионов плотной части двойного слоя. Здесь, как и раньше, за нуль принят потенциал в объеме раствора. Но точка) лежит выше точки 2, отвечающей потенциалу на плоскости, проходящей через центры анионов плотной части двойного слоя, и, следовательно, заряд ( и потенциал) поверхности электрода положителен относительно анионов двойного слоя. [13]
 |
Исправленные тафелевские зависимости процесса электровосстановления комплексов Fe ( CN T ( 3 33 - 1 ( Г М на Hg-электроде, полученные в присутствии катионов разных щелочных металлов. [14] |
Это было объяснено [276] специфической адсорбцией анионов S2O1 - при небольших отрицательных зарядах поверхности электрода, приводящей к увеличению скорости их электровосстановления. [15]
Страницы: 1 2 3 4 5