Возрастание - скорость - реакция
Cтраница 1
Возрастание скорости реакции при наложении поля обусловлено увеличением концентрации возбужденных молекул в результате ускорения вторичных тепловых электронов. [1]
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент реакций различен. Это на первый взгляд небольшое значение температурного коэффициента обусловливает, однако, большое возрастание скорости реакции при значительном повышении температуры. [3]
Возрастание скорости реакции внутри области воспламенения, как было показано выше, не может быть беспредельным. Для того чтобы найти максимально возможные в данных условиях значения ( Н) и со, необходимо учесть еще выгорание исходных веществ. Такого рода расчеты были проведены Ковальским и позднее Семеновым [17] для малых давлений ( рСр2), при которых можно пренебречь скоростью реакции ( VII) объемного обрыва цепей. [4]
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. [5]
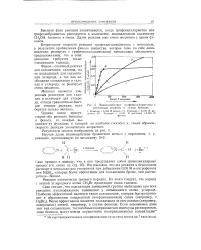 |
Взаимодействие, трифенилхлорметана с метиловым спиртом в сухом бензоле. [6] |
Возрастание скорости реакции трифенилгалоидметана с метанолом, в результате прибавления фенола ( вещества, которое само по себе лишь медленно реагирует с трифенилгалоидметаном) превосходно объясняется предположением, что в этих реакциях требуется также сольватация галоида. [7]
Возрастание скорости реакции трифенилгалоидметана с метанолом в результате прибавления фенола ( вещество, которое само по себе лишь медленно реагирует с три-фенилгалоидметаном) объясняется предположением, что в этих реакциях требуется также сольватация галоида. [8]
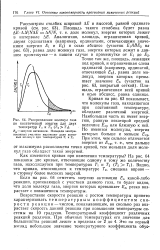 |
Распределение молекул газа гию равную некоторой средней. [9] |
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. [10]
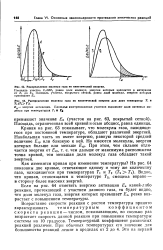 |
Распределение молекул газа по кинетической энергии.| Распределение молекул газа по кинетической энергии для двух температур Т, и. [11] |
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. [12]
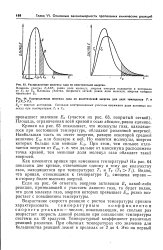 |
Распределение молекул газа по кинетической энергии.| Распределение молекул газа по кинетической анергии для двух температур Г, и. [13] |
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости р е а кци и - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. [14]
 |
Схема образования активных и неактивных фермент-субстратных комплексов.| Влияние концентрации ацетилхолина на скорость его. [15] |
Страницы: 1 2 3 4
