Возрастание - скорость - реакция
Cтраница 2
Возрастание скорости реакции с повышением темп-ры качественно отражает обычную для всех хи-мич. [16]
Возрастание скорости реакции со временем может быть свя-зано с катализом этой реакции конечными продуктами. Таким образом, наличие или отсутствие самоускорения не может служить доказательством цепного механизма реакции или, наоборот, его отсутствия. [17]
Возрастание скорости реакции с ростом температуры принято характеризовать температурным коэффициентом скорости реакции - числом, показывающим, во сколько раз возрастает скорость данной реакции при повышении температуры системы на 10 градусов. Температурный коэффициент различных реакций различен. [19]
Хорошо известное возрастание скорости реакции при повышении температуры обусловлено, по существу, возрастанием доли реагирующих молекул, запас энергии которых превышает требуемый минимум. [20]
Это возрастание скорости реакции с увеличением концентрации трехокиси серы в серной кислоте легко можно понять, если рассмотреть его с точки зрения Льюиса. Скорее всего оно обусловлено общим возрастанием кислотности. Трехокись серы - более сильная кислота, чем серная. Льюис и Бигелейзен [82] показали, что кислотность растворов серной кислоты растет с концентрацией трехокиси серы. Эта тесная связь указывает, что конденсация о-бензоилбензойной кислоты является реакцией, катализируемой кислотами, и что скорость реакции не зависит от того, какая именно кислота является катализатором, а зависит от силы кислотности. Вероятно, тремя главными участвующими кислотами являются SO3, H2SO4 и H3O 1, но вопрос об их точной пропорции не имеет значения, так как можно измерить общую кислотность. [21]
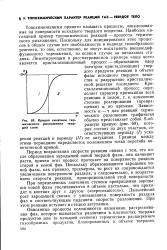 |
Кривая кинетики термического разложения твердой соли. [22] |
Период возрастания скорости реакции связан с тем, что после образования зародышей новой твердой фазы, они начинают расти, причем этот процесс протекает на поверхности раздела старой и новой фаз. Поскольку образовавшиеся зародыши новой фазы, как правило, трехмерны, то рост их сопровождается увеличением поверхности раздела, а следовательно, и возрастанием скорости реакции, пропорциональной этой поверхности. Дальнейший рост зародышей связан с уменьшением поверхности раздела фаз и соответствующим падением скорости разложения. При этом реакция вступает в стадию затухания. [23]
Для объяснения неравномерного, ускоряющегося возрастания скорости реакции инверсии тростникового сахара с увеличением температуры Аррениус привлек представление об участии в реакции только активных молекул ( действительно реагирующих тел), количество которых очень быстро растет с повышением температуры. [24]
Увеличение температуры вызывает возрастание скорости реакции изомеризации. [25]
 |
Состав продуктов реакции СС14 - - иС2Н4 С1 ( СН2СН2 пСС13 ( в вес. %. [26] |
С повышением давления наблюдается возрастание скорости реакции и увеличение числа молекул этилена п, входящих в образующиеся соединения. [27]
При значительном повышении температуры возрастание скорости реакции оказывается весьма существенным. [28]
С повышением давления наблюдается возрастание скорости реакции и увеличение числа молекул этилена п, входящих в образующиеся соединения. [29]
Увеличение этого соотношения способствует возрастанию скорости реакции во много раз. Введение избытка четырехокиси азота в количестве 42 - 72 % по отношению к теоретически необходимому ( весовое соотношение N2O4: Н2О 6 2 - 7 5), позволило в заводских условиях сократить до 30 - 60 мин продолжительность переработки сырой смеси в концентрированную азотную кислоту. [30]
Страницы: 1 2 3 4