Возрастание - энергия - связь
Cтраница 1
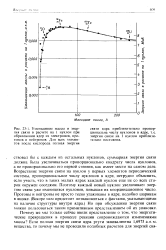 |
Уменьшение массы и энергия связи в расчете на 1 нуклон при образовании ядер из электронов, протонов и нейтронов. Для всех элементов после кислорода полная энергия. [1] |
Возрастание энергии связи на нуклон у первых элементов периодической системы, пропорциональное числу нуклонов в ядре, нетрудно объяснить, если учесть, что в таких малых ядрах каждый нуклон еще не со всех сторон окружен соседями. Поэтому каждый новый нуклон увеличивает энергию связи уже имеющихся нуклонов, повышая их координационное число. Протоны и нейтроны не просто тесно упакованы в ядре, подобно шарикам в ящике. Вскоре нам предстоит познакомиться с фактами, указывающими на наличие структуры внутри ядра. [2]
Такое возрастание энергии связей между двумя атомами свидетельствует о различии а - и тс-связей только в том случае, если предварительно сделать допущение, что энергия простой связи С-С по крайней мере существенно не меняется, если рядом с ней возникает вторая связь ( при переходе С-С - СС), а затем и третья. Без такого предварительного допущения аргументация различия а - и л-связей приведенными величинами энергии их образования не имеет силы. [3]
В результате возрастания энергии связи и относительного содержания адсорбированного водорода на поверхности наблюдается резкий рост удельной скорости поглощения водорода при гидрировании в указанном ряду катализаторов. Особенно значительный эффект был достигнут при широком варьировании количественных соотношений компонентов никель-медного катализатора с промотором на глине. При оптимальном содержании компонентов из-за увеличения энергии связи Н - К происходит наименьшее смещение потенциала катализатора ( 50 мв), и реакция протекает практически мгновенно. Следовательно, для соединений первой группы скорость реакции возрастает пропорционально энергии связи прочноадсорбированного водорода и содержанию его в катализаторе. В случае соединений, восстанавливающихся по электронному механизму ( тг-бензохинон, производные динитродифенилового эфира, нитробензол), скорость воспроизводства водорода увеличивается при возрастании смещения потенциала в анодную сторону при введении электроноакцепторных заместителей ( например, в бензольное кольцр) или применении поотонодонорных растворителей, содержащих аммиак. [4]
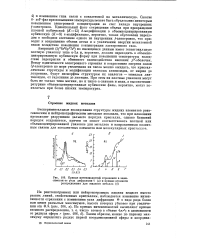 |
Кривые интенсивностей отражения в зависимости от угла дифракции 6 ( а и кривые атомного распределения для жидкого металла ( б. [5] |
Ввиду идентичности электронного строения и возрастания энергии связи 5 / - электронов по мере увеличения их числа можно ожидать, что кристаллические структуры и модификации тяжелых актиноидов, от кюрия до лоуренсия, будут изоморфны структурам их аналогов - тяжелых лантаноидов, от гадолиния до лютеция. При этом их плотные упаковки могут быть не только типа магния, но и типов а-лантана и меди, а высокотемпературные объемноцентрированные кубические фазы, вероятно, могут появляться при более низких температурах. [6]
Важной особенностью карбоксильных катионитов является возрастание энергии связи фиксированных ионов к противоионам с ростом величины положительного заряда последних. Исключение составляют ионы водорода: энергия связи карбоксильного катио-нита с протонами столь велика, что даже разбавленными кислотами легко могут быть вытеснены все катионы металлов, независимо от величины их заряда. С повышением содержания в смоле карбоксильных групп на единицу массы катионита различие в сорби-руемости катионов одновалентных и многовалентных металлов резко возрастает. Это облегчает хроматографическое разделение смесей разновалентных металлов, что весьма существенно для практического использования карбоксильных катионитов в анализе минералов и сплавов. [7]
Важной особенностью карбоксильных катионитов является возрастание энергии связи фиксированных ионов к противоионам с ростом величины положительного заряда последних. Исключение составляют ионы водорода: энергия связи карбоксильного катио-нита с протонами столь велика, что даже разбавленными кислотами легкр могут быть вытес. С повышением содержания в смоле карбоксильных групп на единицу массы катионита различие в сорби-руемости катионов одновалентных и многовалентных металлов резко возрастает. Это облегчает хроматографическое разделение смесей разновалентных металлов, что весьма существенно для практического использования карбоксильных катионитов в анализе минералов и сплавов. [8]
Строго говоря, такой ход возрастания энергии связей между двумя атомами может свидетельствовать о различии а - и тс-связей только в том случае, если предварительно сделать допущение, что энергия простой связи С-С, по крайней мере, существенно не меняется, если рядом с ней возникает вторая связь ( при переходе С-С - СС), а затем - и третья. Без такого предварительного допущения, аргументация различия а - и я-связей приведенными величинами энергии их образования не имеет силы. [9]
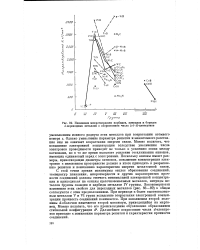 |
Изменение микротвердости карбидов, нитридов и боридов d - переходных металлов с возрастанием числа ( s й - электронов. [10] |
Однако уменьшение параметра решетки и межатомного расстояния еще не означает возрастания энергии связи. Можно полагать, что повышение электронной концентрации вследствие увеличения числа электронов проводимости приводит не только к усилению связи между катионами, но в то же время вызывает усиление отталкивания анионов, имеющих одинаковый заряд с электронами. Поскольку анионы имеют размеры, превосходящие диаметры катионов, повышение концентрации электронов в межионном пространстве должно в итоге приводить к разрыхлению решетки и понижению характеристик энергии межатомной связи. С этой точки зрения максимумы теплот образования соединений, температур плавления, микротвердости и других характеристик прочности соединений должны отвечать минимальной электронной концентрации и приходиться на окислы щелочноземельных металлов, нитриды металлов группы скандия и карбиды металлов IV группы. Закономерности изменения этих свойств для переходных металлов ( рис. 86 - 89) в общем согласуются с этим предположением. При переходе к более высоковалентным металлам V и VI групп вследствие возрастания электронной концентрации прочность соединений понижается. При заполнении второй половины d - оболочки намечается второй максимум, приходящийся на марганец. Дальнейшее возрастание числа d - электро-нов приводит к понижению параметра решетки и характеристик прочности соединений. [11]
Из приведенных данных можно сделать вывод, что пигменты в результате взаимодействия с пленкообразующей основой вызывают либо возрастание энергии связи между звеньями цепей в сетчатой структуре покрытия, либо увеличение частоты сетки, а возможно, и то и другое. Этим и объясняется снижение скорости релаксационных процессов, а следовательно, и увеличение внутренних напряжений. [12]
При образовании трехзарядных ионов остальных лантаноидов наряду с повышением концентрации электронного газа до 2 эл / атом ( способствующей возрастанию энергии связи ионов, о чем можно судить, например, по повышению температур плавления при переходе от бария к лантану, от европия к гадолинию и от иттербия к лютецию) одновременно происходит сжатие внешних рв-оболочек их ионов. Это обстоятельство означает сокращение протяженности р-орбиталей, которые уже не перекрываются. Однако с повышением температуры энергия электронов на внешних р-уровнях возрастает и протяженность р-орбиталей увеличивается. Энергия же свободных электронов и, следовательно, энергия взаимодействия их с ионами существенно не изменяются. Таким образом, расширение р-орбиталей опережает увеличение межатомных расстояний, в области высоких температур наступает перекрытие р-орбиталей и возникает обменное направленное взаимодействие по осям прямоугольных координат. Это приводит к появлению объемноцентрированных кубических высокотемпературных модификаций, свойственных всем лантаноидам. Вследствие лантаноидного сжатия р6 - оболочек ионов появление объемноцентрированной модификации происходит при тем более высокой температуре, чем больше атомный номер лантаноида ( см. рис. 69, а), причем этот же фактор объясняет возрастание и их температур плавления от лантана до самария и от гадолиния до тулия и лютеция. [13]
 |
Зависимость коэффициента разделения от заряда поверхности электрода-обозначения, как на 10. [14] |
В полном согласии с приведенными выше соображениями, коэффициент разделения изотопов возрастает в ряду амальгама TlPbHgGa, совпадающем с рядом возрастания энергии связи. [15]
Страницы: 1 2 3