Дальнейшее возрастание - концентрация
Cтраница 3
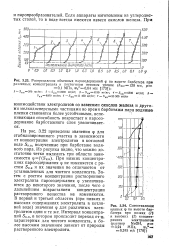
При низких концентрациях паросодержания ф не изменяется с ростом SK. B и их значения не отличаются от установленных для чистого конденсата. Затем с ростом концентрации растворенного электролита паросодержания ф увеличиваются до некоторого значения, после чего с дальнейшим возрастанием концентрации растворенного вещества не изменяются. [32]
 |
Распределение потенциалов в двойном электрическом слое в случае, когда знак электрокинетического потенциала t, противоположен знаку электродного потенциала q. [33] |
Электролитический механизм проявляется как при взаимодействии жидкостей и твердых тел, так и при разделении твердых тел, поверхности которых находились в соприкосновении. Например, при погружении металла в раствор электролита ионы металла переходят в раствор, и на границе металл - электролит протекает ток. Этот процесс длится до образования двойного электрического слоя, обусловливающего возникновение межфазной разности потенциалов, и препятствующего дальнейшему возрастанию концентрации ионов металла в электролите. [34]
Его обнаруживали при обоих исследованных потенциалах, но при - 0 4 В - уже через 15 - 20 мин с дальнейшим возрастанием концентрации, а при - 0 75 В - только через 40 - 50 мин и то в виде следов. [36]
В большинстве случаев при комнатной температуре значения A j отрицательны, так что направление легкого намагничивания совпадает с пространственной диагональю элементарного куба. Порядок величины А колеблется в пределах от 103 до 105 эрг см: а абсолютное значение, как правило, возрастает с понижением температуры. Сравнительно малой концентрации этих ионов ( менее 1 %) достаточно для того, чтобы константа К1 стала положительной; при дальнейшем возрастании концентрации кобальта К1 достигает, в особенности при низких температурах, рекордной величины порядка 10е - 107 эрг / см3 ( фиг. [37]
Концентрация в таких случаях может быть качественно объяснено следующим образом. Поэтому возрастание концентрации раствора приводит к уменьшению расхода реагента. Эта тенденция более сильно проявляется при концентрациях от нуля до некоторой критической. Дальнейшее возрастание концентрации раствора приводит уже к увеличению расхода реагента. Эта тенденция наиболее сильно проявляется при значительных концентрациях. Наложение указанных тенденций дает кривую с более или менее четким минимумом. [38]
Это предельный закон коэффициента активности Дебая - Хюккеля ( так называемый закон корня квадратного), справедливость которого вследствие введения упрощающих предположений в действительности может быть распространена только на бесконечно разбавленные растворы. Согласно экспериментам, этот закон хорошо подтверждается в диапазоне от наиболее разбавленных растворов до концентрации примерно 0 001 моль-л-1: значение IgYca линейно зависит от корня квадратного из концентрации, и наклон прямой ( значение A zcz0) также соответствует теории. Это следует считать хорошим результатом для теории, так как выражение для А включает только некоторые универсальные постоянные, температуру и диэлектрическую проницаемость растворителя и не содержит эмпирические константы, которые следует подгонять к наблюдаемым результатам. При дальнейшем возрастании концентрации, однако, отклонения растут и измеренные значения обычно выше, чем вычисленные ( см. разд. [39]
 |
Зависимость спектров поглощения водных растворов магдалово-го красного от концентрации. / - 1 - Ю-6. 2 - МО-6. 3 - МО 4. 4 - 5 - Ю-4. 5 - 1 - Ю-3. 6 - 2 - Ю-3. 7 - 3 - Ю-3. 8 - 5 - Ю-3 г / мл. [40] |
Характер происходящих при этом изменений виден на рис. 79, где показаны концентрационные деформации электронного спектра поглощения красителя магдаловского красного в воде. Следовательно, в этом диапазоне концентраций образования ассоциированных молекул не происходит и наблюдаемый спектр поглощения принадлежит мономерным молекулам красителя. При дальнейшем возрастании концентрации наблюдается интенсивное уменьшение длинноволновой мономерной полосы поглощения ( А м555 нм) и одновременное появление и быстрое нарастание новой коротковолновой полосы ( Яд 525 нм), принадлежащей возникающим в растворе ассоциированным молекулам маг-далового красного. [41]
Сравнительно незначительное повышение концентрации полимера обусловливает значительное повышение вязкости раствора. При повышении концентрации полимера в прядильном растворе на 2 % вязкость раствора увеличивается примерно в 2 раза. Так, например 8, при повышении концентрации поливинилового спирта в растворе с 12 до 16 % вязкость раствора увеличивается с 500 до 2000 пз. При дальнейшем возрастании концентрации полимера в растворе до 20 % вязкость раствора увеличивается до 6500 пз. [42]
Сравнительно незначительное повышение концентрации полимера обусловливает значительное повышение вязкости раствора. При повышении концентрации полимера в прядильном растворе на 2 % вязкость раствора увеличивается примерно в 2 раза. Так, например8, при повышении концентрации поливинилового спирта в растворе с 12 до 16 % вязкость раствора увеличивается с 500 до 2000 пз. При дальнейшем возрастании концентрации полимера в растворе до 20 % вязкость раствора увеличивается до 6500 пз. [43]
При криоскопическом исследовании концентрированных растворов получаются результаты, противоречившие теории электролитической диссоциации, согласно которой с увеличением концентрации степень диссоциации должна уменьшаться. Следовательно, и молекулярное понижение температуры замерзания должно с увеличением концентрации раствора все время непрерывно уменьшаться. Величины молекулярного понижения точки замерзания и молекулярного повышения точки кипения при возрастании концентрации раствора сначала уменьшаются, достигают минимума и при дальнейшем возрастании концентрации снова значительно возрастают. Джонс нашел, что по мере увеличения относительной массы растворителя в растворах увеличивается и относительное содержание его в образующихся сольватах. [44]
 |
Влияние электролита на относительную вязкость ris ( Л ад-сорбционно насыщенного 3 5 % - него латекса СКС-30 и мутность т ( 2 разбавленных в 10 раз образцов. [45] |
Страницы: 1 2 3 4