Заметная адсорбция
Cтраница 4
США 3288692) получения органических оксидов из олефинов на магнетитовом аноде электролизом галоидных солей. Особого внимания заслуживает применение анодов из оксидов железа в процессах электросинтеза органических соединений на катоде. Отсутствие заметной адсорбции органических веществ на анодах из оксидов железа дает возможность проводить процессы электросинтеза на катоде в электролизере без диафрагмы, не опасаясь потерь исходных веществ и конечных продуктов электролиза вследствие окисления на аноде. Такими свойствами обладают не только аноды из магнетита, но и другие аноды, например из диоксида марганца. [46]
Величину т можно назвать временем адсорбции, она показывает, сколько времени адсорбированная молекула находится на поверхности, прежде чем оторвется от нее. Решающим фактором, определяющим величину т, является теплота адсорбции Q. Расчеты показали, что для достижения заметной адсорбции на поверхности, содержащей 3 5 - 1018 атомов на 1 см2, Q должно быть более 1500 кал / моль. Отсюда можно сделать вывод, что водород и другие газы, способные окклюдироваться металлами, имеют значительные теплоты адсорбции. [47]
Метод, примененный Шубертом с сотрудниками [1 - 12] для определения констант диссоциации многочисленных 1: 1 -комплексов, основан на предположении, что концентрация металла в обеих фазах очень мала, а. Далее предполагается, что MLn является единственным образующимся комплексом, что он не имеет заряда или заряжен отрицательно и представляет собой одноядерный комплекс. Кроме того, не должно происходить заметной адсорбции комплекса на ионите. [48]
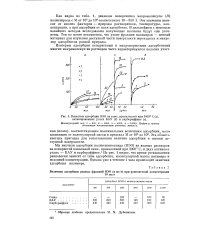 |
Кинетика адсорбции ПЭО на саже, прокаленной при 3000 С ( а, активированных углях БАУ ( б и карбораффине ( в. [49] |
Из рис. 1 видно, что время установления равновесия зависит от типа адсорбента, молекулярной массы полимера и исходной концентрации. Однако уже в течение 1 часа происходит заметная адсорбция полимера. [50]
Для выявления адсорбции хлористоводородной кислоты на по-ливинилхлоридных образцах были поставлены специальные опыты. Опыты показали, что в этом случае заметной адсорбции хлористоводородной кислоты на поливинил-хлоридных образцах не обнаруживается. [51]
К, так и на поверхности апиезон К - сферо-хром-1 практически отсутствует. Это позволяет сделать вывод, что в рассматриваемом случае для обоих соединений Kgi-0 и адсорбционные явления для носителя ИНЗ-600, следовательно, могут быть объяснены только адсорбцией хроматографируемых соединений на его поверхности. Из приведенных данных видно, что на огнеупорном кирпиче ИНЗ-600 наблюдается заметная адсорбция хроматографируемых соединений. [52]
Хотя эта реакция была одной из первых реакций, подвергавшихся исследованию, ее механизм еще неясен. Бентон и Эльгин [110] нашли, что при серебряном катализаторе скорость реакции не зависит от давления кислорода и прямо пропорциональна давлению водорода. Эти кинетические данные согласуются с полученными ими результатами адсорбционных измерений, которые показали нулевую адсорбцию водорода, но заметную адсорбцию кислорода. Они предположили, что газообразные молекулы водорода атакуют адсорбированный кислород. Для того чтобы объяснить наблюдаемую медленную реакцию, они допустили, что могут реагировать только те кислородные атомы, которые находятся рядом со свободными участками. Можно было бы считать, что такая картина согласна с общей точкой зрения, принятой в настоящей статье. Тем не менее хотя золото [111] проявляет аналогичные адсорбционные свойства, скорость реакции оказывается пропорциональной квадратному корню из давления водорода и прямо пропорциональной давлению кислорода. [53]
Было замечено, что на ранней стадии злектроосаждения меди, когда на грани ( 100) медного монокристалла развивается слоистость, увеличение плотности тока осаждения при прочих равных условиях приводит к возрастанию разделения ступеней. Большие расстояния между ступенями в случае осадков, полученных при более высоких плотностях тока, могут быть хотя бы частично отнесены к влиянию адсорбции примесей из раствора. Если скорость осаждения велика, то промежуток времени, разделяющий периоды образования двух последующих слоев, будет недостаточен для заметной адсорбции примесей на свежеобразованной поверхности; в этом случае вновь образующиеся слои будут встречать на своем пути меньше препятствий, вследствие чего группирование идеально моноатомных ступеней в пачки на ранней стадии осаждения должно быть затруднено; даже в том случае, когда произошло первое группирование одноатомных ступеней, такое скопление может довольно легко исчезнуть. По этой причине первые видимые скопления характеризуются меньшей плотностью, или, другими словами, большим разделением, чем последующие. Для ранней стадии осаждения, когда происходит первое концентрирование, или группирование, одноатомных ступеней, повышение чистоты раствора сопровождается уменьшением плотности расположения групп. В результате макроступени, образующиеся в конце концов из этих групп, будут расположены на больших расстояниях одна от другой. [54]
При определении растворимости в присутствии избытка ионов SO j адсорбция могла все же иметь место, так как здесь при той же адсорбирующей поверхности растворенное количество радия значительно меньше. Вероятным в этом случае источником ошибок является еще и то, что профильтрованный раствор непосредственно переносится в барбатор, наполненный разбавленной азотной кислотой, в то время как при определениях растворимости в воде фильтрат сперва разбавлялся раствором хлористого бария. Таким образом, несмотря на предварительную обработку барбатора и присутствие в нем азотной кислоты, при незначительных количествах радия может иметь место заметная адсорбция на стенках сосуда. Однако относительно этих двух источников ошибок при определении растворимости в присутствии избытка ионов SO следует заметить, что существующая опасность адсорбции вследствие малого количества радия, вероятно, устраняется благодаря присутствию в растворе больших количеств других катионов, препятствующих адсорбции радия. Для получения количественных результатов необходимо провести дополнительные исследования с применением других экспериментальных методов с учетом указанных выше ошибок. Это исследование будет проведено одним из нас. [55]
В интервале потенциалов от - f - 0 2 до - 0 2 в катионы тропилия не восстанавливаются. На электрокапиллярных кривых растворов соли тропилия [7] и пиридина [8] в этой области потенциалов наблюдается снижение поверхностного натяжения, что указывает на их заметную адсорбцию. Принято считать, что молекулы ароматических соединений в этих условиях ориентированы параллельно поверхности электрода, что облегчает взаимодействие системы я-электронов ароматических колец со ртутью. Очевидно, что катион тропилий в этом отношении не составляет исключения; следовательно, адсорбционные свойства катиона тропилия также говорят об его ароматическом характере. [56]
Грэм [5,28] считал, что при положительных зарядах поверхности ртутного электрода заметной специфической адсорбции не проявляют только ионы фтора. Однако Паланкер, Скундин и Багоцкий [31] на основании изучения емкости двойного слоя в растворах KF показали наличие некоторой адсорбции ионов F на ртутном электроде. Независимо от них Мак-Кой и Марк [29], сопоставив большое количество экспериментальных данных по плотности зарядов различных адсорбированных анионов gi при разных потенциалах, также пришли к выводу о существовании заметной адсорбции ионов F - в водных растворах при потенциалах положительное - 0 4 в ( относительно норм, к. [57]
Дальнейшее повышение кислотности приводит к растворению осадка окисла, если использованная кислота содержит такой анион, как, скажем, сульфат или хлорид, которые образуют комплексные ионы с металлами. Однако получено мало доказательств существования таких ионов. Исследования по ионному обмену на смолах, выполненные в ходе настоящей работы, показали, что Мо ( VI) совершенно не адсорбируется или адсорбируется в незначительной степени на катионообменной смоле дауэкс-50 из 1 - 12 М растворов НС1 или 1 - 6 М растворов НВг, HF, H2SO4 или HNO3, тогда как на анионообменной смоле ( дауэкс-1) из тех же растворов наблюдалась заметная адсорбция. [58]
Смесь солей двух радиоактивных изотопов можно разделить, прибавляя к содержащему их раствору нерадиоактивный изотоп одного из компонентов смеси - изотопный носитель - и переводя этот носитель в малорастворимую твердую фазу. При полном выделении носителя в осадок происходит практически полный переход в твердую фазу и его радиоактивного изотопа. Другой же компонент радиоактивной смеси остается в растворе, если он не способен соосаждаться или адсорбироваться на поверхности раздела фаз. В случае заметной адсорбции второго компонента смеси в раствор приходится добавлять его изотопный носитель, не способный образовывать самостоятельно твердую фазу, что приводит к предотвращению адсорбции и полному разделению смеси радиоактивных изотопов. [59]
Страницы: 1 2 3 4