Диссоциация
Cтраница 3
Диссоциация этой часта молекулы на ионы может происходить либо с разрывом связи Э - О ( в результате чего отщепляется ион ОН -), либо с разрывом связи О - Н ( что приводит к отщеплению иона Н); в первом случае гидроксид будет проявлять свойства основания, во вто-ром - свойства кислоты. [31]
 |
Ионная схема фрагмента молекулы гидроксида ( ОН. [32] |
Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи Э - О ( в результате чего отщепляется ион ОН -), либо с разрывом связи О - Н ( что приводит к отщеплению иона Н); в первом случае гидроксид будет проявлять свойства основания, во втором - свойства кислоты. [33]
 |
S. Ионная схема фрагмента молекулы гидрокс.. да Э ( ОН Я. [34] |
Диссоциация этой части молекулы на ионы может происходить либо с разрывом связи Э - О ( в результате чего отщепляется ион ОН -), либо с разрывом связи О - Н ( что приводит к отщеплению пока Н); в первом случае гидроксид будет проявлять свойства основания, во втором - свойства кислоты. [35]
Диссоциация и рекомбинация двухатомного газа: N х атомов X и NY атомов Y образуют п молекул XY в объеме Q. Предположим, что в этом объеме находится достаточно инертных молекул, которые сталкиваются с молекулами вещества, и вероятность диссоциации за единичное время оказывается равной г ( / г) сея. [36]
Диссоциация по такому типу называется первичной. [37]
Диссоциация такого рода является, как правило, первой стадией фотохимических реакций, последующие химические изменения определяются свободными радикалами. При освещении коротковолновым светом радикалы могут возбуждаться или получать дополнительную кинетическую энергию. В жидкостях радикалы, обладающие малой избыточной энергией, не могут выйти из сферы окружающих их молекул. При этом они рекомбинируют, энергия, выделяющаяся при рекомбинации, рассеивается в виде тепловых колебаний молекул и никаких химических изменений не наблюдается. Такой процесс, впервые постулированный Франком и Рабиновичем [8], носит название эффекта первичной рекомбинации, или эффекта клетки. Хорошей иллюстрацией эффекта клетки может быть изученная Лампи и Нойесом [9] фото диссоциация иода в различных инертных растворителях. Во всех растворителях квантовый выход был ниже, чем в газах, где продукты диссоциации могут свободно уходить из зоны своего возникновения. Совсем недавно Мидоус и Нойес [10] показали, что эффект клетки может оказывать обратное действие: например, если свободные радикалы успели до рекомбинации пройти сквозь первый слой окружающих молекул, то они будут предотвращать дальнейший контакт радикалов между собой. [38]
Диссоциация - процесс эндотермический и, по-видимому, только в жидкой воде, где происходит сольватация ионов, нужна дополнительная энергия. [39]
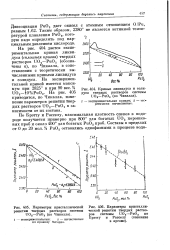 |
Кривые ликвидуса и солидуса твердых растворов системы UO2 - PuO2 ( по Чикалла.| Параметры кристаллической [ IMAGE ] Параметры кристалли. [40] |
Диссоциация Ри02 дает окисел с атомным отношением 0 / Ри, равным 1.62. Таким образом, 2280 не является истинной температурой плавления Ри02, которую надо определять под парциальным давлением кислорода. На рис. 404 дается экспериментальная кривая ликвидуса ( сплошная кривая) твердых растворов U02 - Pu02 ( обозна-чены а), по Чикалла, в сопо-ставлении с теоретически вычисленными кривыми ликвидуса и солидуса. На эксперимен-тальной кривой имеется максимум при 2825 и при 90 вес. [41]
Диссоциация Ри02 дает окисел с атомным отношением О: Ри, равным 1.62. Таким образом, 2280 не является истинной температурой плавления Ри02, которую надо определять под парциальным давлением кислорода. [43]
Диссоциация состоялась лишь тогда, когда протон, перескакивая из одной молекулы воды в другую, настолько удалился от кислотного остатка, что оказался фактически вне его силового поля. [44]
Диссоциация на катион и анион обусловливает электролитическую проводимость раствора, а большое число неспаренных электронов делает его парамагнитным; при этом значение g - фактора показывает, что взаимодействие между молекулами растворителя и электроном весьма слабое. Синяя окраска раствора обусловлена светопоглощением с максимумом при 1500 нм. [45]
Страницы: 1 2 3 4