Диссоциация - ионная пара
Cтраница 2
Предполагается, что различные результаты, наблюдаемые при дезаминировании и разложении триазена, определяются возможностью образования во втором случае ионной пары между бутил - и анилин-ионами, которая реагирует без перегруппировки, только после диссоциации ионной пары происходит 1 2-гидридный сдвиг. Вероятность же образования ионной пары при дезаминировании бутиламина, в которой в качестве аниона выступает перхлорат-анион, интенсивно сольватируемый водой, мала. [16]
 |
Реакция триэтиламина с тетрахлор-п-бензохиноном. [17] |
Вероятно, образование дирадикальной ионной пары как дискретного промежуточного соединения можно доказать при использовании растворителя достаточно полярного, чтобы в строго анаэробных условиях ( поскольку пири-динильные радикалы очень быстро реагируют с кислородом [152]) вызывать диссоциацию ионной пары, и последующем исследовании строения продуктов димеризации радикалов. [18]
Процесс обмена состоит во вращении катиона металла вместе со связанными с ним лигандами внутри ионной пары и в распаде промежуточного продукта на исходные компоненты. BuOH этот процесс происходит быстрее диссоциации ионной пары. В более полярном этиленгликоле происходит обмен с растворителем и карбанион превращается в сольватированный комплекс, содержащий дейтерий и имеющий конфигурацию, обратную исходной. [19]
Смит и Эллиот67, применяя в качестве индикаторов а-нафтол-бензоил и о-нитроанилин, вычислили функцию кислотности Гаммета h0 для разбавленных растворов ряда сильных кислот в ледяной уксусной кислоте. Это было интерпретировано как результат диссоциации ионной пары. [20]
При использовании различных донорных растворителей в системе Дэя и варьировании отношения д опорный растворитель: тетраэтилалюми-нат натрия, данный метод может быть использован для установления момента образования контактной или разделенной растворителем ионной пары. Низкая диэлектрическая проницаемость исходного растворителя - бензола препятствует диссоциации ионной пары, поэтому этим эффектом можно пренебречь. [21]
Однако недавно опубликованные данные указывают на необходимость более1 осторожного применения метода, основанного на измерении ширины линий в спектрах ЭПР. Наблюдалось значительное расхождение результатов определения этим методом констант диссоциации ионной пары, образованной катионами калия с двухзарядным анионом циклооктатет-раена, с результатами, полученными при использовании других методов. [22]
 |
Электрохимическая новка для обессоливания Лугов-2. [23] |
Сухие иониты, входящие в состав ионообменных мембран, как и сухие соли, практически не проводят ток. Однако при набухании их в воде или растворе солей происходит диссоциация ионной пары фиксированный ион - противоион и электрическое сопротивление ионита резко уменьшается. Набухшие иониты являются проводниками второго рода; для них характерны те же особенности, что и для растворов. [24]
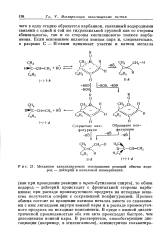 |
Механизм катализируемых основаниями реакций обмена водород - дейтерий и аллильной изомеризации. [25] |
Процесс обмена состоит во вращении катиона металла вместе со связанными с ним лигандами внутри ионной пары и в распаде промежуточного продукта на исходные компоненты. В среде с низкой диэлектрической проницаемостью оба эти акта происходят быстрее, чем диссоциация ионной пары. [26]
Аналогичные ЯМР-исследования Андерсона и Саймонса [5] дали им возможность построить свою шкалу акцепторной способности. На самом деле в ее основе лежит система Косовера с той лишь разницей, что образование и диссоциация ионной пары пиридиний - галогенид, отражающие влияние растворителя, изучаются не спектрофотометриче-ски, а методом ЯМР по величинам химических сдвигов протонов пиридинового кольца. Данные ЯМР позволяют различить 2 6 - и 3 5-про-тоны, а взаимодействие между галогенид-ионом и атомом азота пири-диния оказывает на эти пары протонов различное влияние. Таким образом, разница в величинах химических сдвигов этих двух типов протонов является мерой влияния растворителя. [27]
Первая же работа по криптатам [36] показала их резко активирующее действие на большинство процессов анионной полимеризации. Оказалось, что в случае больших противоионов наблюдаемая константа скорости роста падает с разбавлением и увеличением степени диссоциации ионной пары. [28]
Следовательно, механизм быстрого образования триплетных состояний в типичных гетероэксимерных системах ароматический углеводород - амин, находящихся в сильно полярных растворителях, приходится исключить. Так, существование триплетного состояния обнаруживается уже через 50 не после наносекундного лазерного импульса, т.е. раньше чем должна произойти диссоциация сольватированной ионной пары. [29]
Лихтин с сотрудниками [95] условно разделяют изученную ими реакцию на две стадии. Они считают, что изотопный эффект проявляется лишь на стадии образования ионной пары, предполагая при этом, что стадия диссоциации ионной пары не зависит от введения изотопа в молекулу. Из вышеизложенного, однако, следует, что такое предположение может оказаться неверным, если отщепляющаяся группа остается в ионной паре достаточно тесно связанной с а-углеродным атомом. Тем не менее, если даже допустить, что авторы правы и что гиперконъюгационный изотопный эффект действительно отсутствует на стадии образования ионной пары, то из этого вовсе не должно следовать, что никакого эффекта не будет наблюдаться на стадии переходного состояния, приводящего к образованию ионной пары и являющегося, как недавно было отмечено Поккером [97], промежуточным между диполем и ионной парой. [30]
Страницы: 1 2 3