Диссоциация - связь
Cтраница 1
Диссоциация связи С - Не образованием карбаниона для алифатических углеводородов протекает большим трудом. Она облегчается, если в молекуле присутствуют электрофильные группы, содействующие стабилизации карбаниона. [1]
Энергия диссоциации связи ( D) есть энергия, необходимая для гомо-литичсского разрыва данной связи, рассчитанная на моль вещества. [2]
Энергия диссоциации связи CH3S - H выше, чем таковая связи СН3 - SH [135], но в организме образуются как R - -, так и RS - ионы. [3]
Энергии диссоциации связей О - Н ( см. табл. 7.18) закономерно изменяются и могут быть представлены в виде ряда: D ( спирты) D ( ХОСН2ОН) D [ ХОС ( О) СН2ОН ] D [ ХС ( О) СН2ОН ], X Н или Me. В исследуемом ряду соединений отсутствует корреляция между D ( RO - Н) и с ( Н) - константами Тафта для заместителей алифатического ряда. [4]
Энергия диссоциации связи С - Н равна 104 - 121 ккал. Нами было выбрано как наиболее вероятное [6] значение, равное ПО ккал. Имеющиеся данные по энергиям связей, хотя и недостаточные, показывают, что все другие возможные реакции диссоциации ацетилена ( разрыв тройной связи С-С или двух отдельных связей) требуют значительно большей энергии и, следовательно, вероятно, не будут играть существенной роли, пока не будут достигнуты более высокие температуры. [5]
Равновесие диссоциации связей с небольшой энергией расщепления уже при низких температурах заметно смещено в сторону продуктов диссоциации. Так, в бензольном растворе до 1 5 % гексафенилэтана ( Ее-с 11 ккал / моль) диссоциировано на трифенилметильные радикалы. Относительно устойчивые радикалы, легко образующиеся таким путем, называются также стабильными радикалами. [6]
Энергией диссоциации связи в молекуле Ri - R2 называется изменение энергии А. Ri - R2 - Ri R2, участники которого находятся в состоянии идеального газа. При этом имеется в виду, что продукты реакции находятся в основных состояниях. [7]
Энергии диссоциации связей представляют большой практический интерес, поскольку знание их позволяет определить скорости реакций, особенно свободнорадикальных. Наиболее полные данные, касающиеся энергий диссоциации связей фтор-органических соединений, получены методом электронного удара. [8]
Равновесие диссоциации связей, для расщепления которых необходима небольшая энергия, уже при низких температурах заметно смещено в сторону продуктов диссоциации. Так, например, в 0 1 М бензольном растворе 1-дифенилметилен - 4-трифенилметпл-циклогексаднена - 2 53) ( ДсЯс-с - 11 ккал / моль) при комнатной температуре до 2 % вещества диссоциировано на трифенилметнль-ые радикалы [ уравнение ( ГЛ. [9]
Энергия диссоциаций связи ( D) есть энергия, необходимая для гемолитического разрыва данной свя и, рассчитанная на моль вещества. [10]
Энергии диссоциации связей, например представленное в табл. 12.1, полезны также для определения энергетического баланса индивидуальных стадий в последовательности - свободнорадинальных реакций. [11]
Равновесие диссоциации связей, для расщепления которых необходима небольшая энергия, уже при низких температурах заметно смещено в сторону продуктов диссоциации. [12]
Энергии диссоциации связей представляют большой практический интерес, поскольку знание их позволяет определить скорости реакций, особенно свободнорадикальных. Наиболее полные данные, касающиеся энергий диссоциации связей фтор-органических соединений, получены методом электронного удара. [13]
Энергия диссоциации связи в mpem - бутилпероксиде равна 37 ккал / моль, и это сосдпнеппе часто используют для инициирования свободнораднкальных реакций. Принимая, что предэкспонешщальный множитель ( фактор Аррениуса) А равен Ю с 1, рассчитайте величину константы скорости диссоциации при 100 С. [14]
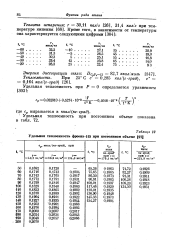 |
Удельная теплоемкость фреона-115 при постоянном объеме. [15] |
Страницы: 1 2 3 4