Азеотропизм
Cтраница 2
В системах с азеотропизмом объемное поведение в закритической области приобретает еще более сложный вид. [16]
В настоящее время проблема азеотропизма три низких давлениях развивается главным образом в сторону исследования многокомпонентных систем, классификации их и систематизации особенностей таких систем. [17]
О каких же областях азеотропизма ( рассмотрим этот вопрос на примере положительных азеотропов) нам известно из существующих экспериментальных данных. [18]
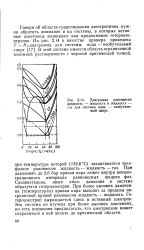 |
Диаграмма равновесия жидкость - жидкость и жидкость - газ для системы вода - изобутиловый спирт. [19] |
Говоря об области существования азеотропизма, нужно обратить внимание и на системы, в которых истинные азеотропы возникают как продолжение гетероазе-отропов. [20]
Диаграммы равновесия систем с азеотропизмом в критической области очень сильно отличаются от диаграмм для простых систем. В двойной смеси с положительным азеотропом пространственная критическая кривая имеет температурный минимум. На фазовой диаграмме при этих параметрах появляется двойная критическая точка. При более высоких температурах изотермы равновесия распадаются на две раздельные области, в каждой из которых есть своя критическая точка. [21]
Итак, наличие в системе азеотропизма с открытой областью приводит к появлению на критической крч-вой двух особых точек. Одна из них связана непосредственно с формой критической кривой для таких систем. Это точка температурного экстремума, соответствующая двойной критической точке. [22]
Однако отличительные черты систем с азеотропизмом не сводятся только к специфическому поведению самой азеотропной смеси. Они проявляются и за ее пределами. Особенно отчетливо это заметно в характере объемного поведения подобных систем. Действительно, например, существование азеотропа уже при низких давлениях приводит к появлению экстремума на линии газа изотермы равновесия v - Ni, причем состав в точке этого экстремума не совпадает с составом азеотропа. В гомогенной области газообразной ( для положительного азеотропа) фазы изобары - изотермы v - Ni должны обязательно проходить через максимум, что влечет за собой, как будет показано далее, появление особенностей в концентрационной зависимости ряда термодинамических величин. Появляются, как мы увидим, и другие очень важные следствия. [23]
Фазовое поведение двойных систем с азеотропизмом в критической области резко отлично от поведения обычных двойных систем в этой области. [24]
Отличит, черты систем с азеотропизмом не исчерпываются существованием в них А. Особенно отчетливо это проявляется в объемном поведении системы. Из-за того что на изотермах общего давления пара имеются экстремумы, изотерма объема для паровой фазы обязательно имеет минимум у систем с положит, азеотропом и максимум у систем с отрицат. При этом составы, соответствующие экстремумам, вследствие неидеальности паровой фазы не совпадают с составами А. [26]
Однако сложность поведения систем с азеотропизмом в закритической области этим не исчерпывается. Помимо точек перегиба, на изобарах - изотермах v - Nf появляются максимумы. [27]
Обнаруженное явление аналогично хорошо известному эффекту азеотропизма в жидких растворах, когда совпадают составы жидкой и паровой фазы. [28]
Обычно критические температуры компонентов смеси с азеотропизмом различаются мало. Поэтому компонент с меньшим значением b имеет большее ( иногда значительно - табл. 3.1. и 4.1) критическое давление. Это значит, что с увеличением концентрации второго компонента с молекулами большего объема критическое давление в системе будет падать [ ( dP / dAf2) K. Независимо от того, будет ли первый компонент иметь более низкую критическую температуру, или более высокую, из-за наличия температурного минимума на этой ветви критической кривой и производная ( dTjdN2) KK будет меньше нуля. Отсюда ясно, что линия азеотропа должна выходить на ту часть критической кривой, для которой ( о ( Р / с. Когда мы говорим должна, то следует напомнить, что это не термодинамическая необходимость. Просто в большинстве случаев наблюдается именно такая картина. Все определяется уравнением состояния - природой системы. Мы уже приводили в качестве примера систему этилен - двуокись углерода, для которой ранее не был найден температурный минимум на критической кривой. Линия азеотропов в этой системе подходит к критической кривой близко к середине концентрационного интервала. Как оказалось, температурный минимум на критической кривой неглубок и лежит в области разбавленных растворов. [29]
Известен целый ряд систем, в которых азеотропизм охватывает ограниченную область параметров, начинаясь на оси одного чистого компонента и заканчиваясь на оси другого компонента. Это системы, для которых выполняется правило Банкрофта ( см. гл. [30]
Страницы: 1 2 3 4
