Дальнейшая диссоциация
Cтраница 3
Если этот процесс одноступенчатый, то на скорость-определяющей стадии перестают соблюдаться два условия, так что вклад AV от дальнейшей диссоциации связи на величину от 5 до 10 см3 - моль-1 положи-тельнее, чем при нормальном Е1 - элиминировании. [31]
После гидролиза в слабо щелочных средах животного организма образуются гидроокиси металлов, которые могут действовать уже в таком виде, не подвергаясь дальнейшей диссоциации или только очень мало разрушаясь. Таким образом, ядовитое действие оказывают циркулирующие и отложившиеся гидроокиси металлов или же эти гидроокиси в коллоидально-дисперсном состоянии. Вопрос сравнительной токсичности гидроокислов сравнительно с окислами или солями тех же металлов экспериментально почти не изучен. К тому же в действии гидроокислов специфическую роль может играть высокий рН ( щелочность) растворов гидроокисей, с чем может быть отчасти связана картина и сила дей-ствия их сравнительно с эффектами других соединений данного металла. На примере опытов с двумя металлами нами получены неодинаковые результаты. Так, при введении под кожу мышей эквивалентных количеств металла - никеля в виде его закиси или же ее гидрата - они в равной мере ока-зались мало эффективными. В то же время гидроокись никеля [ № ( ОН) 3 ] оказалась значительно токсичнее окиси: при дозе окиси 50 мг Ni / кг не погибло ни одно животное, между тем как та же доза в виде гидроокиси привела к гибели всех животных. Напротив, гидроокись бария была менее токсична для мышей, чем окись. [32]
После гидролиза в слабо щелочных средах животного организма образуются гидроокиси металлов, которые могут действовать уже в таком виде, не подвергаясь дальнейшей диссоциации или только очень мало разрушаясь. Таким образом, ядовитое действие оказывают циркулирующие и отложившиеся гидроокиси металлов или же эти гидроокиси в коллоидально-дисперсном состоянии. Вопрос сравнительной токсичности гидроокислов сравнительно с окислами или солями тех же металлов экспериментально почти не изучен. К тому же в действии гидроокислов специфическую роль может играть высокий рН ( щелочность) растворов гидроокисей, с чем может быть отчасти связана картина и сила дей-ствия их сравнительно с эффектами других соединений данного металла. На примере опытов с двумя металлами нами получены неодинаковые результаты. Так, при введении под кожу мышей эквивалентных количеств металла - никеля в виде его закиси или же ее гидрата - они в равной мере ока зались мало эффективными. В то же время гидроокись ни келя [ Ni ( OH) 3 ] оказалась значительно токсичнее окиси: при дозе окиси 50 мг Ni / кг не погибло ни одно животное, между тем как та же доза в виде гидроокиси привела к гибели всех животных. Напротив, гидроокись бария была менее токсична для мышей, чем окись. [33]
Диссоциация полиэлектролитов не может произойти в сколько-нибудь заметной степени без замены одного иона на другой, так как она приводит к возрастанию заряда, препятствующего дальнейшей диссоциации. [34]
Величина Kz по сравнению с Ci настолько мала, что для оценки концентрации ионов водорода вполне можно учитывать только первую стадию; изменения же равновесной концентрации Н2РО4 в ходе дальнейшей диссоциации пренебрежимо малы, и можно считать, что на первой и второй стадиях ионизации она сохраняется практически одной и той же. [35]
Исследования масс-спектров пятичленных нафтеновых углеводородов, проведенные Стивенсоном [103], показали, что под действием электронного удара происходит перегруппировка возбужденного молекулярного иона в соответствующий ион олефина, который претерпевает дальнейшую диссоциацию. Так, например, при диссоциации метилциклопентана, меченого С13, не отрывается непосредственно метильная группа, а протекает ряд последовательных реакций разложения, приводящих к образованию метильных и других более тяжелых осколочных ионов. [36]
Связываясь с гидроксильными ионами воды, ионы образуют слабодиссоциирующую гидроокись аммония, в результате чего уменьшается произведение активности водородных и гидроксильных ионов ( ан QOH -), что ведет к дальнейшей диссоциации некоторого количества молекул воды. [37]
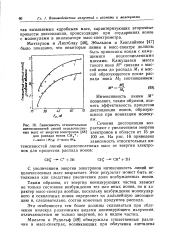 |
Зависимость относительных интенсивностей линий нецелочисленных масс от энергии электронов для распада ионов СН3. 1-масса 11 / 15. 2-масса 93 / 5. [38] |
Таким образом, от энергии ионизирующих частиц зависит не только состояние возбуждения тех или иных ионов, но и характер масс-спектра вообще, поскольку возбуждение молекулярного и осколочных ионов определяет их дальнейшую диссоциацию и, следовательно, состав конечных продуктов распада. [39]
Связываясь с гидроксильными ионами воды, ионы NHJ образуют слабодиссоциирующую гидроокись аммония, в результате чего уменьшается произведение активности водородных и гидроксильных ионов ( ан - йон -) что ведет к дальнейшей диссоциации некоторого количества молекул воды на ионы. Вследствие связывания ионов ОН ионами аммония в слабо диссоциирующие молекулы NH4OH в растворе появляется избыток водородных ионов. [40]
В области валентных колебаний связи О - Н, кроме центрального максимума, соответствующего смещенной на 90 слг1 в низкочастотную сторону полосе поглощения H2SO4, с высокочастотной стороны появляется интенсивная полоса поглощения с максимумом 3220 слг1 возможно, отвечающая колебаниям связи О - Н в Р ( ОН) 4 При дальнейшем увеличении концентрации Н3РО4 в смеси ( 33 % H2SO4 и 67 % Н3РО4) в спектре появляются полосы поглощения, отнесенные к колебаниям иона Н3О ( 3310, 2900 и 1750 слт1) и иона SOl - ( 1100 слг1), образующихся в результате отщепления воды от Р ( ОН) 4 - с образованием РО ( ОН) 2 и дальнейшей диссоциации серной кислоты до ЗО - иона. [41]
При температуре кипения плотность пара точно соответствует теоретическому значению для молекул Pi, а при более высоких температурах ниже теоретической величины. Дальнейшая диссоциация Р2 - 2Р возможна при нагревании до температуры выше 1473 15 К. В работах [21, 38] приводятся уравнения для вычисления константы равновесия реакций Р4 2Р2 и Р2 2Р, пользуясь которыми можно рассчитать молекулярный состав паров фосфора. [42]
Степень диссоциации до лонов СиОАс варьирует приблизительно от 10 % ( при наибольшей концентрации NaOAc, равной 0 75 М / л) приблизительно до 25 % ( при наименьшей ( концентрации, равной 0 25 М / л); ацетат натрия добавлялся в качестве буфера. Дальнейшая диссоциация до ионов Си2 происходит в ничтожной - степени. [43]
СиОАс варьирует - приблизительно от 10 %: ( при наибольшей концентрации NaOAc, равной 0 75 Ml л) приблизительно до 25 % ( при наименьшей концентрации, равной 0 25 М / л); ацетат натрия добавлялся в качестве буфера. Дальнейшая диссоциация до ионов Си2 происходит в ничтожной степени. [44]
Было показано, что при очень высоких температурах галиды ЭГ2 ( где Г - F, C1) частично диссоциируют по схеме ЭГ2 f ЭГ Г с образованием устойчивых в газовой фазе производных одновалентных щелочноземельных металлов ( ср. Дальнейшая диссоциация галидов ЭГ на атомы требует затраты около 130 ( F) или 100 ( С1) ккал / мояь. [45]
Страницы: 1 2 3 4