А-кетоглутарат
Cтраница 3
Алании превращается в пируват непосредственно в реакции трансами-нирования с а-кетоглутаратом. Четырех-углеродная аминокислота треонин расщепляется с образованием двухуглерод-ной аминокислоты глицина, который может подвергаться дальнейшим превращениям по двум путям. Из предыдущего мы уже знаем ( разд. Однако главный путь катаболизма глицина ведет через другую реакцию, также требующую присутствия тетрагидро-фолата. [31]
Алании ( или Глутамат) - АЛК Пируват ( или а-кетоглутарат) ] ( фиг. [32]
Окислительное декарбокснлирование а-кетюглутарата, катализируемое а-кетоглутарат дегидрогеназой, входящей в состав а-кетоглутарат дегндрогеназ-ного комплекса ( см. § 4.1), приводящее к образованию сукцшшлкофермспта А и выделению второй молекулы СО. [33]
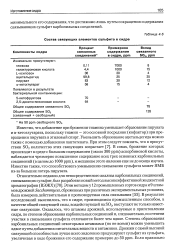 |
Состав связующих элементов сульфита в сидре. [34] |
Известно, что добавление при брожении тиамина уменьшает образование пирувата и а-кетоглутарата, поскольку тиамин - это основной посредник ( кофактор) при превращении пирувата в этиловый спирт. [35]
 |
Реакция трансаминирования. Переносимая аминогруппа выделена красным. В большей части реакций трансаминирования акцептором аминогрупп служит а-кетоглутарат. [36] |
Итак, общим акцептором, принимающим аминогруппу от большинства аминокислот, является а-кетоглутарат. Образовавшийся L-глутамат служит для того, чтобы направлять аминогруппы на определенные биосинтетические пути ( гл. Это означает, что величина ДО0 для таких реакций близка к нулю ( разд. [37]
У аммониотелических животных аминогруппы от различных аминокислот передаются в реакциях трансаминирова-ния на а-кетоглутарат, что приводит к образованию глутамата. В митохондриях печени при участии глутаматдеги-дрогеназы происходит окислительное де-заминирование этого глутамата с образованием свободного аммиака. Будучи крайне токсичным, свободный аммиак не может транспортироваться кровью; он включается в виде амидной группы в глу-тамин, образующийся под действием глутаминсинтетазы. Нетоксичный нейтральный глутамин затем переносится кровью в жабры. [38]
Глутамат после дезаминирования может превратиться в цикле трикарбоновых кислот в аспартат через а-кетоглутарат, сукцинат, фумарат, малат и оксалоацетат. Оксалоацетат затем превращается в аспартат путем пере-аминирования с глутаматом, а образующаяся при этом молекула сс-кетоглутарата используется для окисления аспартата. [39]
Обратная последовательность реакций, при которой происходит синтез аминокислот из а-кетокислот ( а-кетоглутарата) и аммиака, была названа трансреаминированием. [40]
На III этапе ацетил - КоА ( и некоторые другие метаболиты, например а-кетоглутарат, оксалоацетат) подвергаются окислению ( сгоранию) в цикле ди - и трикарбоновых кислот Кребса. [41]
Обратимость действия глутаматдегидрогеназы означает, что избыток глутамата может легко превратиться обратно в а-кетоглутарат. [42]
Другой возможный путь биосинтеза глутамата - это зависимое от пири-доксальфосфата траисаминирование с использованием а-кетоглутарата ( см. в гл. [43]
Аминокислоты глутамат, аспартат, аланин и глицин образуются непосредственно из а-кето-кислот ( а-кетоглутарата, оксалоацетата, пирувата и глиоксилата соответственно) в результате восстановительного аминирования и пере-аминирования. Аспартат, глутамат и глицин являются предшественниками других аминокислот, а также пуринов, пиримидинов и порфири-нов. [44]
 |
Схема превращения целлюлозы в белки животного через биомассу микроорганизмов. [45] |
Страницы: 1 2 3 4