Азидогруппа
Cтраница 2
Хотя находящиеся рядом нитро - и азидогруппы стерически предрасположены к замыканию фуроксаиового цикла, все же начальные валентные углы и межатомные расстояния достаточно сильно отличаются от соответствующих величин в цикле. Поэтому для циклизации обе группы должны качнуться навстречу друг другу достаточно сильно, преодолевая закрепленность их в молекуле, для чего и требуется определенная энергия активации. [16]
При перегруппировке азидов азидокислот в амины азидогруппа часто может остаться без изменения, если только она не находится в а-положении. [17]
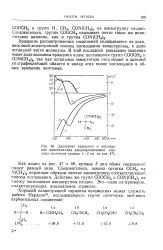 |
Дисперсия вращения и поглощение диметиламида азидопропионовой кислоты ( значение кривых / - 5 на 47. [18] |
CON ( CH3) 2 на азидогруппу сходно. [19]
Обычно при реакции азидов с галоидмагнийорганическими соединениями азидогруппа превращается в триазеновую группу, но известны примеры, когда реакция идет в другом направлении. [20]
Различие между этими двумя величинами связано с влиянием содержания азидогрупп на светочувствительность. С физической точки зрения это обусловлено не сопровождающейся сшиванием потерей некоторого количества имидосоединений, образующихся в качестве промежуточных продуктов, что подтверждается отсутствием адгезии при низких степенях сшивания. [21]
Образуются при разложении арил-или алкилазидов и других в-в, содержащих азидогруппу; промежут. N-галогенимидов или N-галогенаминов со щелочами, нитрозо - и нитросоедине-ний - с сильными восстановителями ( напр. Легко изомеризуются в имины; присоединяют Н, образуя амины; димеризуются в азосоединения или образуют гетероциклы. [22]
Образуются при разложении арил-ш алкилазидов и других в-в, содержащих азидогруппу; промажут, соединения в р-циях N-галогенимидов или N-галогенаминов со щелочами, нитрозо - и нитросоедине-ний - с сильнымл восстановителями ( напр. Легко изомеризуются в имины; присоединяют Н, образуя амины; димеризуются в азосоединения или образуют гетероциклы. [23]
Вращение рассматриваемых соединений складывается из доли, вносимой анизотропией полосы поглощения азидогруппы, и доли остальной части молекулы. В этой последней решающее значение имеет доля величины вращения полос поглощения групп СООСН3 и GON ( GH3) 2, так как остальные заместители поглощают в дальней ультрафиолетовой области и вклад этих полос поглощения в общее вращение ничтожен. [24]
Арилазиды при этих условиях достаточно устойчивы, если только нуклеофильное замещение азидогруппы не облегчено наличием сильной электронооттягивающей группы. Арилазиды реагируют с соляной кис лотой. [25]
Фенилацетиленид натрия также вступает в реакцию с 0-хлорэтилазидом, по-видимому взаимодействуя с азидогруппой [22], а не с атомом хлора. [26]
Судя же по знаку реакционной константы р в приведенном выше уравнении Гаммета, азидогруппа в рассматриваемой реакции термолиза ведет себя именно как центр, подлежащий нуклеофильной атаке, т.е. оттягивание от него электронов способствует реакции. [27]
Судя же по знаку реакционной константы р в приведенном выше уравнении Гамметз, азидогруппа в рассматриваемой реакции термолиза ведет себя именно как центр, подлежащий нуклеофильной атаке, т.е. оттягивание от него электронов способствует реакции. [28]
Активирование первичных ароматических аминов с помощью диазотирования используется для введения нитро - и азидогрупп. За исключением тетрафторбора-тов, соли диазония, как правило, не выделяют. [29]
Однако сходство простирается лишь до известного предела, так как при вытеснении соответствующего фрагмента азидогруппа имеет тенденцию превращаться в нитрен, а аминогруппа - в имииогруппу с отрицательным зарядом. [30]
Страницы: 1 2 3 4