Кислотная диссоциация
Cтраница 1
Кислотная диссоциация может протекать также с отщеплением молекулы воды по типу Н3ЭО3 Н - ЭОг Н2О, причем получаются соли мета-мышьяковистой ( HAsO2) и леетасурьмянистой ( HSbO2) кислот. [1]
Кислотная диссоциация при этом подавлена. [2]
Кислотная диссоциация шлш-триазола не изучалась, однако кислотный характер этого соединения подтверждается образованием из него мононатриевой [232] и серебряной [303] солей. [3]
Кислотная диссоциация может протекать также с отщеплением молекулы воды по типу Н3ЭО3 H - j - ЭОг f H. [4]
Кислотная диссоциация может протекать также с отщеплением молекулы воды по типу Н3ЭО3 ч - Н ЭО. [5]
 |
График к определс - тический метод определения молеку. [6] |
Кислотная диссоциация при этом подавлена. [7]
Кислотная диссоциация красителя вызывает изменение наклона прямых, но последнее обстоятельство можно учесть при построении калибровочных графиков. [8]
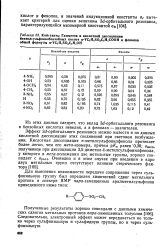 |
Константы Гамметта и кислотной диссоциации бензолсульфонилбензойных кислот n - YCo SC Ce COOH и фенолов общей формулы n - YC6H4SO2C6H4OH. [9] |
Кислотная диссоциация я-метилсульфонилфенола протекает более легко, чем его жега-изомера, причем рЛа равен - 0 30; аэксп. [10]
Кислотная диссоциация карбоксильных групп приводит к небольшим гипсохромным и гипохромным эффектам. [11]
Кислотная диссоциация гидридных комплексов переходных металлов возможна лишь тогда, когда отрицательный заряд аниона ( сопряженного основания), образующегося при отрыве протона, может быть делокализован по нескольким сильным электроноакцепторным лигандам, в особенности СО-группам. Кроме того, обращению полярности связи М - Н может способствовать энергетический выигрыш сольватации протона в водных или спиртовых растворах. Пока мы рассмотрели лишь стадию актнаации водорода, а теперь проследим дальше каталитический цикл гидрирования на катализаторе Уилкннсона. [12]
Кислотной диссоциации иона аммония по схеме NHj r NH3 f H отвечают следующие значения константы: 8 - 10 - п при 0 С, 6 - 10 - 10 при 25 С и 3 - 10 - 9 при 50 С. [13]
Кислотной диссоциации иона аммония по схеме NH - - NH3 Н отвечает следующие значения константы: 8 - Ю-11 при О С, 6 - Ю-10 при 25 С и 3 - Ю-9 при 50 С. Таким образом, диссоциация эта очень мала и не может идти ни в какое сравнение с диссоциацией аммонийных солей по обычному для них типу. Сродство радикала NH2 к электрону оценивается в 25 ккал / моль. [14]
Если кислотная диссоциация одной из координированных молекул RH очень резко преобладает над кислотной диссоциацией остальных протонсодержащих молекул, то кислотная диссоциация комплексного иона может мало зависеть от химической природы этих пассивных молекул. [15]
Страницы: 1 2 3 4