Вольфрамата
Cтраница 2
Вольфраматы восстанавливаются хлоридом двухвалентного олова, цинком, алюминием в солянокислом растворе до окисла W2O5 синего цвета. [16]
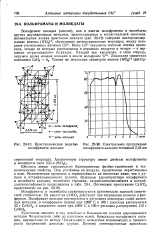 |
Кристаллическая решетна [ IMAGE ] - 20. Спектральное пропускание вольфрамата кальция вольфрамата кальция толщиной 2 54 мм. [17] |
Вольфраматы и молибдаты характеризуются сравнительно высокой химической стойкостью. Из кислот на CaWOj действуют при нагревании соляная и фосфорная. [18]
Вольфраматы являются производными вольфрамовой кислоты H2WO4, которая осаждается при действии минеральных кислот из растворов своих солей в виде белого осадка. Реакцию образования H2WO4 Н2О применяют для отделения WVI от других ионов. С органическими кислотами H2WO4 образует комплексные соединения. [19]
Вольфраматы, паравольфраматы и первольфраматы получаются из нормальной вольфрамовой кислоты ( H2WO4) и других вольфрамовых кислот. [20]
Вольфраматы по своему каталитическому влиянию на разложение перекиси водорода весьма напоминают молибдаты. Возможно, что каталитическое действие обусловлено образованием этих соединений. Изменения скорости в зависимости от концентрации перекиси в этих кислых растворах имеют точно такой же характер, как и в случае молибдата. В интервале, соответствующем первому порядку, скорость пропорциональна концентрации вольфра-мата и обратно пропорциональна концентрации кислоты. Богданов предполагает существование двух промежуточных соединений, образующихся из VOi - -, ОН и одной или двух молекул перекиси водорода, с помощью которых можно объяснить кинетику по схеме, напоминающей схему, приведенную выше для молибдатов. Однако нет никаких других доводов в пользу соединения с одной молекулой перекиси водорода, и кинетику, соответствующую как первому, так и второму порядку, невидимому, можно объяснить при помощи одного и того же промежуточного соединения, так как приведенное выше уравнение при некоторых концентрациях перекиси имитирует первый порядок. [21]
Вольфраматы восстанавливаются хлоридом двухвалентного олова, цинком, алюминием в солянокислом растворе до окисла W. [22]
Вольфраматы восстанавливаются хлоридом двухвалентного олова, цинком, алюминием в солянокислом растворе до окисла W2OS синего цвета. [23]
Вольфраматы являются производными вольфрамовой кислоты H2WO4, которая осаждается при действии минеральных кислот из растворов своих солей в виде белого осадка. Реакцию образования H2WO4 - H2O применяют для отделения WVI от других ионов. С органическими кислотами H2WO4 образует комплексные соединения. [24]
Вольфраматы, так же как и молибдаты, не дают волны восстановления ни в нейтральных, ни в щелочных растворах. В кислых растворах вольфраматы дают сложные полярограммы, состоящие из нескольких волн; механизм восстановления вольфраматов еще не установлен. [25]
Вольфраматы находят большое техническое применение для изготовления экранов для рентгенографии, утяжеления тканей и придания последним огне - и водостойкости, в производстве красок и пр. [26]
Вольфраматы восстанавливаются в солянокислом растворе хлоридом двухвалентного олова, цинком, алюминием до окисла W2O5 синего цвета. [27]
Вольфраматы являются производными вольфрамовой кислоты HaWO4, которая осаждается при действии минеральных кислот из растворов своих солей в виде белого осадка. Реакцию образования H2WCvH20 применяют для отделения WVl от других ионов. Безводная желтого цвета растворяется в растворе аммиака и чах, но не растворяется в кислотах ( отличие от HaMoOj. С органическими кислотами H2WO4 образует комплексные соединения. [28]
Вольфраматы висмута, твердые растворы SnO2 - МоО3, SnO2 - Sb2O5, Fe2O3 - SbaO5 также катализируют окислительный аммонолиз пропилена, но уступают по активности висмут-молибденовым катализаторам. [29]
Вольфраматы рубидия и цезия; плавятся соответственно при 959 2и958 2; при 1200 разлагаются. При 100 они почти полностью теряют воду. Имеют по два полиморфных превращения. [30]
Страницы: 1 2 3 4