Восстановление - ион - металл
Cтраница 2
 |
Схема включения электролизеров. [16] |
Возможность восстановления ионов металлов или неметаллов другими металлами может быть определена при помощи формулы Мориста. [17]
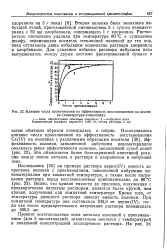 |
Влияние числа прокачиваний яа аффвктианость восстановления на колонке [ ( температура - комнатная. [18] |
Процент восстановления иона металла колонкой с прокачиванием ( для 5 прокачиваний) значительно меняется с температурой и начальной концентрацией исследуемого раствора. [19]
Возможность восстановления ионов металлов или неметаллов другими металлами может быть определена при помощи формулы Нернста. [20]
При восстановлении ионов металлов природа и состояние поверхности катода не остаются постоянными в процессе электро -, лиза, что отражается на величине потенциала катода и скорости процесса. При этом могут быть случаи облегчения ( смещение потенциала в сторону электроположительных значений) и затруднения ( смещения потенциала в сторону электроотрицательных значений) разряда ионов. [21]
При восстановлении ионов металла на катоде построение кристаллической решетки совершается обычно со скоростью, значительно превышающей скорость, с которой ( происходит упорядочение структуры решетки, так как последний процесс относится к категории диффузионных, которые в металле при низких температурах завершаются в бесконечно большие промежутки времени. В условиях такой кристаллизации возникают кристаллы с неравномерно распределенными силовыми полями, обусловливающими появление в осадке внутренних напряжений. [22]
При восстановлении ионов металла на катоде происходит ряд последовательных процессов: перенос гидратированных ионов к электроду, деформация гидратной оболочки с одновременным вытеснением чужеродных частиц с поверхности электрода, освобождение ионов от гидратной оболочки, адсорбция и миграция их к активным участкам электрода, разряд ионов и включение образующихся атомов металла в кристаллическую решетку. Однако последовательность стадий электрохимических реакций не является вполне определенной. [23]
Сопряженные реакции восстановления ионов металла и окисления восстановителя могут протекать достаточно эффективно только на поверхности, обладающей каталитическими свойствами, поэтому обрабатываемый материал подвергают еще одной специальной обработке, называемой активацией. Сущность процесса активации состоит в придании поверхности материала каталитических свойств по отношению к реакции восстановления ионов осаждающегося металла. [24]
Нередко процесс восстановления ионов металла при постоянном потенциале ускоряется в присутствии восстановителя; это показывает, что последний является не только источником электронов, но оказывает и специфическое активирующее воздействие на катодный процесс, возможно путем непосредственно химического взаимодействия. Поэтому следует полагать, что в ходе каталитического процесса наряду с электрохимическими протекают и чисто химические реакции. Экспериментальные данные показывают, что при химическом никелировании анодное окисление гипофосфита лимитируется гетерогенной химической реакцией. [25]
На кинетику восстановления ионов металла существенно влияет состояние поверхности электрода, меняющееся вследствие окисления либо адсорбции некоторых частиц вещества из раствора. Последние затруднения зависят от присущих им особенностей и будут рассмотрены особо. [26]
Важным обстоятельством при восстановлении ионов металла водородом является участие его в реакции в атомарном, а не в молекулярном виде. Процесс Н2 - н2Н протекает при адсорбции газообразного водорода на зернах металла, служащих катализатором, поэтому процесс вытеснения носит ярко выраженный гетерогенный характер. [27]
Способ основан на восстановлении ионов металла на каталитически активной поверхности металлического или неметаллического электрода восстановителем, находящимся в растворе. Химическим способом могут быть восстановлены ионы никеля, кобальта, железа, хрома, кадмия, олова, палладия, платины, меди, серебра, золота, родия, рутения. [28]
Важным обстоятельством при восстановлении ионов металла водородом является участие водорода в реакции не в молекулярном, а в атомарном виде. Процесс Н2 - 2Н протекает при адсорбции подаваемого газообразного водорода на зернах металла, поэтому процесс вытеснения носит ярко выраженный гетерогенный характер. Для начала вытеснения в раствор необходимо вводить затравку - зерна порошка никеля или железа, служащие катализатором. Дальнейшее восстановление может протекать уже с участием порошка, образующегося при вытеснении. [29]
Важным обстоятельством при восстановлении ионов металла водородом является участие его в реакции в атомарном, а не в молекулярном виде. Процесс Н2 - - и2Н протекает при адсорбции газообразного водорода на зернах металла, служащих катализатором, поэтому процесс вытеснения носит ярко выраженный гетерогенный характер. [30]
Страницы: 1 2 3 4