Восстановление - окислитель
Cтраница 2
Неравенство скоростей окисления металлов и восстановления окислителя на их поверхностях означает, что для поддержания стационарного состояния, которому отвечает потенциал фс, необходимо перетекание электронов от металла Me, к Мец. Действительно, скорость окисления металла Ме1 превосходит скорость восстановления окислителя на его поверхности. Избыточные электроны, освобождающиеся вследствие окисления Меь только частью расходуются на восстановление окислителя на поверхности этого металла. Частью же они должны перетекать к металлу Мец и расходоваться на восстановление окислителя, происходящее на его поверхности. При таком распределении скоростей окисления и восстановления у поверхностей металлов должны произойти изменения концентрации раствора. [16]
С повышением температуры уменьшается перенапряжение восстановления окислителя. Особенно это важно для коррозионного процесса, протекающего с катодным контролем. С увеличением температуры увеличивается скорость диффузии веществ, участвующих в процессе или образующихся в результате электродной реакции. [17]
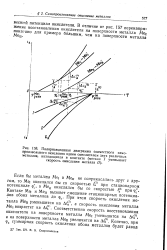 |
Поляризационная диаграмма совместного самопроизвольного окисления одним окислителем двух различных металлов, находящихся в контакте ( металл / уменьшает скорость окисления металла / /. [18] |
В отличие от рис. 157 перенапря жение восстановления окислителя на поверхности металла Mei показано для примера большим, чем на поверхности металла Меп. [19]
Выписываем в ионной форме уравнения полуреакций восстановления окислителя и окисления восстановителя. [20]
При химическом типе коррозии окисление металла и восстановление окислителя протекают в одном акте. Скорость химической коррозии определяется основными закономерностями кинетики химических гетерогенных реакций. В ряде случаев установлена возможность протекания коррозии по электрохимическому механизму с участием химических реакций. [21]
Этой скорости окисления должна соответствовать равная скорость восстановления окислителя гк. [22]
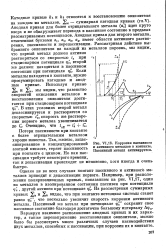 |
Коррозия пассивного и активного металлов в контакте. Пассивный металл активируется. [23] |
Катодные кривые ki и kz относятся к восстановлению окислителя на каждом из металлов, 2к - суммарная катодная кривая ( гл. Анодная кривая для более отрицательного металла ( а [) идет круто вверх и не обнаруживает перехода в пассивное состояние в пределах рассматриваемых потенциалов. Анодная кривая для второго металла, отмеченная буквами at, а, а3, а4) имеет области активного растворения, пассивности и перепассивации. Рассматривая действие выбранного окислителя на каждый из металлов порознь, мы видим, что первый металл должен активно растворяться со скоростью ia при стационарном потенциале фс, второй же должен находиться в пассивном состоянии при потенциале фс. Если металлы находятся в контакте, нужно просуммировать катодные и анодные кривые. [24]
Подготовленные таким образом частные уравнения окисления восстановителя и восстановления окислителя почленно сложить и вывести общее уравнение окислительно-восстановительной реакции. [25]
 |
Влияние природы окислителей на степень - их восстановления редокситом ЭО-7 из 0 001 н. окислителей на фоне 1 н. Я2504. [26] |
Это отражается на ходе кинетических кривых для степени восстановления окислителей из разбав ленных растворов. Как видно из рис. 38, во взаимодействие с окислителями вступает не только восстановленная, но, и окисленная формы смолы. В табл. 11 приведены значения разности нормальных потенциалов редокоита и раствора и коэффициентов диффузии окислителей в растворе и степени их восстановления редокситом. [27]
Чтобы подчеркнуть возможную обратимость этого процесса, продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя - его окисленной формой. [28]
Чтобы подчеркнуть возможную обратимость этого процесса, продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя - его окисленной формой. Например, для К С СЬ ( в присутствии H2SO4) восстановленной формой является Сг2 ( 8О4) з, а для спирта окисленной формой - альдегид. [29]
Чтобы подчеркнуть возможную обратимость этого процесса, продукт восстановления окислителя называется восстановленной формой, а продукт окисления восстановителя - его окисленной формой. Например, для К2Сг2О7 ( в присутствии H2SO4) восстановленной формой является Cr2 ( SO4) 3, а для спирта окисленной формой - альдегид. [30]
Страницы: 1 2 3 4