Восстановление - окислитель
Cтраница 4
В присутствии восстановителей, в том числе и НС1, происходит восстановление окислителей и MnOl; поэтому нельзя подкислять растворы соляной кислотой. [46]
В присутствии восстановителей, в том числе и НС1, происходит восстановление окислителей и МпО; поэтому нельзя подкислять растворы соляной кислотой. [47]
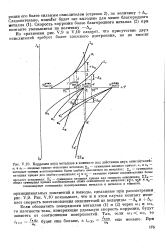
V10 показывает, что и в этом случае контакт изме-няет скорость восстановления окислителей на величины - Дк и АК-Если обозначить поверхности металлов ( 1) и ( 2) через coi и а2, то плотности тока, измеряющие удельную скорость коррозии, будут зависеть от соотношения поверхностей. [49]
Метод полуреакций основан на составлении ионных уравнений для процессов окисления восстановителя и восстановления окислителя с последующим суммированием их в общее уравнение. Легко уяснить и физическую картину процессов. [50]
Это вполне возможно, если допустить, что электроны, необходимые для восстановления окислителя, переходят к ионам в растворе из валентной зоны полупроводника, а не из зоны проводимости. Уход электронов из валентной зоны вызывает увеличение концентрации дырок в полупроводнике, а следовательно, и повышение скорости реакции анодного растворения германия. [51]
Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал восстановления используемого окислителя больше потенциала окисления используемого восстановителя. [52]
Для процессов контактного обмена также характерно протекание реакции окисления атомов металла электрода и восстановление окислителя, находящегося в растворе, только окислителем являются ионы более электроположительного металла. Как указано выше ( см. разд. [53]
Метод полуреакций основан на составлении ионных уравнений для процесса окисления восстановителя и процесса восстановления окислителя с последующим суммированием их в общее уравнение. Легко уяснить и физическую картину процессов. [54]
Конечно, при срс суммарная скорость окисления обоих металлов будет равна суммарной скорости восстановления окислителя на их поверхности. [55]
Страницы: 1 2 3 4