Восстановление - гипохлорит
Cтраница 1
Восстановление гипохлорита [90] было исследовано на вращающемся парафинированном графитовом электроде. [1]
Восстановление гипохлорита начинается при потенциале 0 86 В и хлората при 0 63 В. [2]
Восстановление гипохлорита начинается при е0 0 86 В и хлората при е0 0 63 В. Ион гипохлорита восстанавливается легче иона хлората. [3]
Чтобы воспрепятствовать восстановлению гипохлорита, в электролит добавляют небольшие количества ( 0 1 %) Na2Cr2O7, СаС12 или канифольного Мыла. [4]
Чтобы воспрепятствовать восстановлению гипохлорита, в электролит добавляют небольшие количества ( 0 1 %) Ыа2Сг2От, СаСЬ или канифольного мыла. [5]
Величина предельного тока восстановления гипохлорита ограничивается диффузией и возрастает с увеличением концентрации гипохяорита и с ростом температуры. [6]
 |
Электролизер с биполярными платиновыми электродами. [7] |
В целях уменьшения потерь за счет восстановления гипохлорита на катоде добавляют в электролит хлористый кальций и глицериновое или ализариновое масло. [8]
Такая зависимостетпузводяет считать, что скорость восстановления гипохлорита на катоде и окисления на аноде ограничивается конвекционной диффузией гипохлорита из объема к электродным поверхностям. Тогда для снижения потерь выхода по току по этой причине следует уменьшать диффузию гипохлорита к электродам, повышать плотность тока или увеличивать скорость циркуляции раствора между электродами. [9]
Выделение кислорода в атмосферу уменьшается, а скорость восстановления гипохлорита при этом почти такая же, как и в отсутствие органики. В качестве катализаторов в исследованиях использованы свежеосажденная окись кобальта и хлорид кобальта. [10]
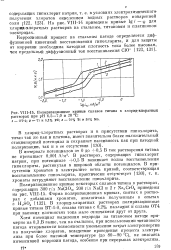 |
Поляризационные кривые сплавов титана в хлорид-хлоратных растворах при рН 6 5 - 7 0 и 20 С. [11] |
В растворах, содержащих гипохлорит натрия, при потенциале 0 5 В возникает волна восстановления гипохлорита, растянутая в широкой области потенциалов. [12]
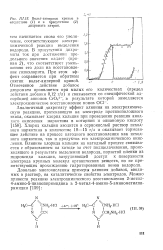 |
Вольт-амперные кривые в. [13] |
В присутствии дихромата ток при достижении предельного значения падает ( кривая 2), что соответствует уменьшению его доли на восстановление гипохлорита. При этом эффект сохраняется при обратном снятии вольт-амперной кривой. [14]
На катоде при электролизе водных растворов хлоридов щелочных металлов в электролизерах с твердым катодом кроме разряда водорода могут протекать процессы восстановления гипохлорита и хлората, присутствующих в виде примесей в раствор, поступающем через диафрагму в катодное пространство. Эти процессы нельзя рассматривать как вредные, так как они приводят к полной или частичной очистке электролитических щелоков от гипохлорита и хлората. Однако в производствах гипохлоритов, хлоратов или при электролитическом окислении хлоратов до перхлоратов в без-циафрагменных электролизерах процессы катодного восстановления гипохлоритов и хлоратов могут значительно снижать выход целевого продукта по току. Для уменьшения процессов катодного восстановления промежуточных продуктов и конечных продуктов при проведении окислительных процессов принимают специальные меры - разделение электродных пространств диафрагмами, подбор материала катода, введение специальных добавок. Так, например, добавляют хромовокислые соли к электролиту при электрохимическом окислении водного раствора хлористого натрия до хлората. Образующаяся на поверхности катода - пористая пленка хромовых соединений затрудняет диффузию ионов гипохлорита и хлората к работающей поверхности катода, что снижает потери тока на катодное восстановление. [15]
Страницы: 1 2 3