Восстановление - гипохлорит
Cтраница 2
На катоде при электролизе водных растворов хлоридов щелочных металлов в электролизерах с твердым катодом кроме разряда водорода могут протекать процессы восстановления гипохлорита и хлората, присутствующих в виде примесей в раствор, поступающем через диафрагму в катодное пространство. Эти процессы нельзя рассматривать как вредные, так как они приводят к полной или частичной очистке электролитических щелоков от гипохлорита и хлората. Однако в производствах гипохлоритов, хлоратов или при электролитическом окислении хлоратов до перхлоратов в без-диафрагменных электролизерах процессы катодного восстановления гипохлоритов и хлоратов могут значительно снижать выход целевого продукта по току. Для уменьшения процессов катодного восстановления промежуточных продуктов и конечных продуктов при проведении окислительных процессов принимают специальные меры - разделение электродных пространств диафрагмами, подбор материала катода, введение специальных добавок. Так, например, добавляют хромовокислые соли к электролиту при электрохимическом окислении водного раствора хлористого натрия до хлората. Образующаяся на поверхности катода - пористая пленка хромовых соединений затрудняет диффузию ионов гипохлорита и хлората к работающей поверхности катода, что снижает потери тока на катодное восстановление. [16]
К пробе анализируемой сточной воды ( 10 - 100 мл в зависимости от ее щелочности) приливают в небольшом избытке ( по сравнению с требуемым для восстановления гипохлорита) 3 % - ный раствор пероксида водорода, предварительно нейтрализованного по фенолфталеину; нагревают до прекращения выделения кислорода, охлаждают, прибавляют еще немного фенолфталеина и титруют кислотой до обесцвечивания раствора. [17]
К пробе анализируемой сточной воды ( 10 - 100 мл, в зави-симости от ее щелочности) приливают в небольшом избытке ( по сравнению с требуемым для восстановления гипохлорита) 3 % - ный раствор перекиси водорода, предварительно нейтрализованный по фенолфталеину, нагревают до прекращения выделения кислорода, охлаждают, прибавляют еще немного фенолфталеина и титруют кислотой до обесцвечивания раствора. [18]
К пробе анализируемой сточной воды ( 10 - 100 мл, в зависимости от ее щелочности) приливают; в небольшом избытке ( по сравнению с требуемым для восстановления гипохлорита) 3 % - ный раствор перекиси водорода, предварительно нейтрализованный по фенолфталеину, нагревают до прекращения выделения кислорода, охлаждают, прибавляют еще немного фенолфталеина и титруют кислотой до обесцвечивания раствора. [19]
По мере накопления в электролите гипохлорита натрия приобретают все большее значение процессы электрохимического и химического окисления его до хлората, а также химического разложения гипохлорита с выделением кислорода, если в растворе присутствуют примеси, катализирующие процесс разложения гипохлорита. На катоде могут протекать процессы восстановления гипохлорита и хлората. [20]
 |
Данные, характеризующие влияние добавок на выход по току ПБН. [21] |
Большое практическое значение имеют добавки, предотвращающие потери продукта электролиза в результате реакций, протекающих на электродах противоположного знака. При потенциалах первой ветви вольт-амперной кривой происходит восстановление гипохлорита. [22]
Изучено [ ЮОа ] поведение титана, платины и стальных катодов в хлорид-хлоратных растворах. Плотность тока катодной защиты стальных поверхностей должна быть выше предельного диффузионного тока процесса восстановления гипохлорита. Титан и платина в хлориД - хлоратных растворах в присутствии активного хлора пассивны и без наложения тока поляризации. [23]
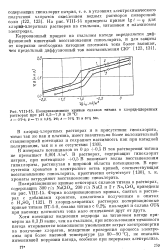 |
Поляризационные кривые сплавов титана в хлорид-хлоратных. [24] |
В интервале потенциалов от 0 до 0 5 В ток растворения титана не превышает 0 001 А / ма. В растворах, содержащих гипохлорит натрия, при потенциале 0 5 В возникает волна восстановления гипохлорита, растянутая в широкой области потенциалов. [25]
Зависимость электрохимических свойств титана от состояния его поверхности особенно сильно сказывается при низких плотностях тока. В присутствии хромата при низких плотностях тока снижается перенапряжение выделения водорода, облегчается восстановление окисной пленки на титане и затрудняется восстановление гипохлорита. Это объясняется адсорбционными явлениями. Адсорбция хроматов на аноде, по-видимому, изменяет механизм восстановления окисной пленки и затрудняет доступ анионов гипохлорита к поверхности катода. [26]
После азеотропной отгонки основной массы хлорметанов сточные воды направляют на адсорбционную доочистку активным углем КАД-йодный. Поскольку в эти сточные воды попадают стоки так называемых санитарных колонн, содержащие небольшие количества гипохлорита, то перед подачей вг адсорбционные колонны в сток вводят бисульфит для восстановления гипохлорита до хлористого натрия. Без этой операции гипохлорит на активном угле, являющемся катализатором окисления, интенсивно реагирует с адсорбированными веществами, в результате чего образуются осмелившиеся продукты, интенсивно окрашенные в бурый цвет и переходящие в фильтрат. [27]
В тех случаях, когда необходимо получить особо точные данные по составу примесей, суммарное содержание которых составляет всего 2 - 3 %, проводят анализ с большим количеством газа - несколько литров, вместо обычных 100 мл. Для этого хлор и диоксид углерода поглощают в специальной бюретке раствором щелочи и затем раздельно определяют. В поглотительном растворе после восстановления гипохлорита пероксидом водорода определяют хлорид. Диоксид углерода определяют газоволюметрическнм методом, выделяя СО2 из щелочного поглотительного раствора соляной кислотой и измеряя объем газа в градуированной бюретке. [28]
Протекание на электродах параллельно с основными процессами образования нужных ( целевых) продуктов других побочных электродных процессов, к которым могут быть отнесены: разряд на аноде ионов ОН или других кислородсодержащих ионов с выделением кислорода вместо хлора, окисление ионов СЮ до хлорат-ионов, разряд ионов Вг -, если они присутствуют в рассоле. Нежелательными побочными процессами являются также процессы хлорирования различных органических соединений, содержащихся в графитовых анодах или применяемых для их пропитки. Кроме того, на катоде может происходить восстановление гипохлоритов и частично хлоратов, что приводит к понижению выхода по току для водорода. [29]
Затем к раствору прибавляют карбонат кальция до появления едва заметного осадка. Раствор нагревают до кипения, осторожно по стенке приливают 2 мл раствора формната натрия, кипятят 2 - 3 мин и охлаждают. Добавляют 5 мл раствора иодида калия, жидкость должна оставаться бесцветной, что показывает полноту восстановления гипохлорита формиатом. Приливают 20 мл соляной кислоты, 1 - 2 капли раствора мо-либдата аммония и титруют выделившийся иод из микробюретки раствором тиосульфата натрия до перехода окраски в светло-желтую. Добавляют 1 мл раствора крахмала и продолжают титрование до обесцвечивания раствора. [30]
Страницы: 1 2 3