Попеременное восстановление
Cтраница 2
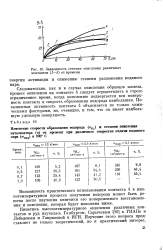 |
Зависимость степени окисления различных контактов ( 1 - 5 от времени. [16] |
Возможность практического использования контакта 4 в низкотемпературном процессе получения водорода может быть решена после изучения кинетики его попеременного восстановления и окисления, которая будет изложена ниже. [17]
Весь контакт нельзя назвать катализатором, так как большая его часть - железо - претерпевает изменение при попеременном восстановлении и окислении и служит переносчиком кислорода от окислителя - воды - к восстановителю - топливу. [18]
Описаны общие закономерности реакции восстановления окислов металлов разными топливами и окисления металлов водяным паром при использовании одной загрузки контакта и ее длительном попеременном восстановлении и окислении. [19]
Для определения оптимальных условий получения водорода при использовании в качестве восстановителей многобалластных газов и газов, содержащих большое количество окиси углерода, изучалось попеременное восстановление и окисление контакта 4 окисью углерода, доменным газом, воздушным генераторным газом и водяным паром. [20]
В табл. 33 приведены составы газов при степенях восстановления контакта 46 - 84 %, при которых он должен работать в стационарных условиях попеременного восстановления и окисления контакта. [21]
В зарубежной промышленности перекись водорода производится, в основном, органическими методами; особенно широко применяется так называемый хинонный процесс, основанный на попеременном восстановлении и окислении антрахинонов. [22]
В качестве промышленного катализатора этой реакции используется окись железа с добавкой окиси хрома, алюминия и калия. При катализе происходит попеременное восстановление и окисление поверхностного слоя катализатора. [23]
Вторая стадия регенерации катализатора идентична обратной реакции процесса кислородного обмена. Скорость окисления S02 через попеременное восстановление - окисление VaOs - должна быть во много раз медленнее кислородного обмена, который в свою очередь протекает в 10 раз медленнее катализа на данном катализаторе. Следовательно, сравнение скоростей показывает, что и в этом случае процесс идет не по окислительно-восстановительному механизму. Еще более убедительно сравнение скоростей обмена и каталитического окисления нафталина. Эта реакция протекает при 400; при этой температуре обмен на VvQs идет неизмеримо медленнее, чем реакция окисления, и в рамках окислительно-восстановительной схемы невозможно объяснить различие в скоростях этих процессов. [24]
На рис. 11 представлено изменение химической активности пяти различных образцов в течение 40 - 70 циклов работы препаратов. Химическая активность изученных препаратов в процессах попеременного восстановления и окисления не остается постоянной: она понижается. Особенно резко снижается активность в течение первых циклов. Однако примерно после десяти циклов снижение химической активности резко замедляется и наступает период стабильной работы препарата. [25]
Установлено, что поверхности этих активных окисей восстанавливаются окисью углерода. Поэтому возможно, что катализ осуществляется с попеременным восстановлением и окислением поверхности. Этот механизм был предложен Бентоном [161] для окисления на двуокиси марганца. Как скорость восстановления несмешанного катализатора, так и скорость каталитического окисления на нем пропорциональны давлению окиси углерода. С точки зрения более поздних данных этот механизм, по-видимому, маловероятен: при использовании О18 было показано [162], что скорость восстановления поверхности в 10 раз меньше скорости каталитического окисления. Другие механизмы включают реакцию между газами, хемосорбирован-ными на поверхностях окисей, или реакцию между окисью углерода из газовой фазы и кислородом, в той или иной форме хемосор-бированным на поверхности. Стоун [164] подверг анализу результаты исследований, проведенных многими учеными, включая ученых бристольской школы, и показал, что имеется качественная связь между активностями различных окисей и их полупроводниковыми свойствами. К их числу относятся двуокись марганца и некоторые из окисей, используемых в гопкалитах. [26]
В процессах окисления существует выбор между двумя возУэж - ньши механизмами - стадийным и слитным. Реакции, осуществляющиеся по стадийному механизму, идут путем попеременного восстановления и окисления катализаторов, с непосредственным участием в процессе кислорода окисла. Одним из доказательств в пользу стадийного механизма является совпадение скоростей гомо-и гетеромолекулярного обмена кислорода. Второй путь проверки правильности стадийного механизма процесса связан с непосредственным определением скорости восстановления окисла водородом и последующим измерением скорости окисления восстановленного образца. Сопоставление этих скоростей со скоростью суммарного процесса окисления водорода на данном катализаторе позволяет однозначно решать вопрос о реализации того или иного механизма. [27]
Постоянная активность и стационарный процесс обычно устанавливались после 6 - 7 циклов попеременного восстановления и окисления контакта. В стационарном процессе контакт восстанавливается и окисляется на одну и ту же величину. [28]
Основной вывод из этих работ заключается в том, что в окисных катализаторах при температурах около 200 и выше поверхностный кислород обладает значительной подвижностью. Окисление СО кислородом на МпО2 / Мп2Оз, СиО и Fe3O4 протекает путем попеременного восстановления и окисления поверхности катализатора, так что кислород из кристаллической решетки окисла появляется в продукте. Однако возможность быстрого обмена СОг с поверхностью катализатора полностью не исключена. [29]
Вопреки указанию некоторых авторов, установлено, что добавки окиси натрия к окиси железа оказывают катализирующее влияние на ее восстановление водородом, окисью углерода и их смесями. Возможность практического применения контакта 4 для металло-парового процесса будет выяснена при рассмотрении его попеременного восстановления и окисления. [30]
Страницы: 1 2 3