Время - жизнь - комплекс
Cтраница 1
Времена жизни комплексов, определяемые этими равновесиями, сложным образом зависят от концентраций частиц. [1]
Время жизни комплекса определяется, как правило, периодом вращения молекулы на угол 2я ( и по порядку величины составляет 10 - 12 о), а чтобы комплекс можно было считать активированным, его время жизни должно составлять несколько периодов вращения. [2]
Время жизни комплекса определяется, как правило, периодом вращения молекулы на угол 2я ( и по порядку величины составляет Ю - 2 с), а чтобы комплекс можно было считать активированным, его время жизни должно составлять несколько периодов вращения. [3]
Если время жизни комплексов М ( 0) Xft, образующихся при протекании стадии (VI.2), достаточно велико, а степень заполнения ими поверхности электрода значительна, то они будут препятствовать образованию комплексов М ( г) Хй, ионы металла которых непосредственно связаны с атомами металла на поверхности электрода. [4]
Косвенно это подтверждается и временем жизни комплексов [ Cd2 Ag п ] и [ Mn2 AgD ] B AgCl, которое по данным электромиграционных опытов ( см. гл. VIII) оказалось равным - 10 - 3 с при 470 - 520 К - Стабилизации комплексов [ Fe3 Na п ] и [ Fe3 Ag G ] благоприятствует и тот факт, что заряд примесного иона равен 3, что затрудняет движение вакансии. [5]
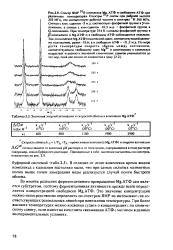 |
Значения энергий активации и скоростей обмена в комплексе Mg-АТФ. [6] |
В отличие от этого комплекса время жизни комплекса с кальцием настолько мало, что при самых сильных магнитных полях выше точки замерзания воды реализуется случай почти быстрого обмена. [7]
Таким образом, исследование концентрационной зависимости времени жизни комплекса позволяет установить механизм реакции обмена и найти константу скорости. В тех системах, где обмену предшествует диссоциация комплекса, энергии активации близки энтальпиям образования комплексов. При бимолекулярном замещении Еа, как правило, значительно ниже энтальпий образования комплексов. Представления о влиянии стерического эффекта на механизм обмена, например, были привлечены для объяснения зависимости механизма реакций обмена в системах [597, 617] ( CH3) nH3 nN - Ga ( CH3) 3 - f Ga ( CH3) r от числа метильных групп п в молекуле амина. Следовательно, обмен здесь становится возможным лишь после диссоциации комплекса. В комплексах H3N - Ga ( CH3) 3 и H2 ( CH3) N-Ga ( CH3) 3 стерические затруднения для атаки Ga ( CH3) 3 значительно меньше. В этом случае бимолекулярное переходное состояние становится стабильным и обмен может идти путем замещения. [8]
Недавно путем изучения раздельных сигналов удалось измерить времена жизни комплексов, определяющиеся различными типами равновесий. Как отмечалось выше, простейшее равновесие (2.5) устанавливается междубинарным комплексом АН - - В и несвязанными молекулами. К сожалению, изучение такого простого процесса возможно только в редких случаях, поскольку большинство протонодонорных молекул способно к самоассоциации. При низких температурах это приводит к образованию различных комплексов, включающих более двух молекул. [9]
Если и М является атомом, то время жизни комплексов очень мало и они снова распадутся, если только не произойдет их столкновения с М или X за время, которое не может быть намного больше периода молекулярного колебания. [10]
Наибольший интерес с теоретической точки зрения представляют времена жизни комплексов в газовой фазе при отсутствии возмущений со стороны среды. Эти величины легче поддаются теоретическому вычислению, механизм процессов в газовой фазе в принципе может быть изучен более детально. [11]
Если и М является атомом, то время жизни комплексов очень мало и они снова распадутся, если только не произойдет их столкновения с М или X за время, которое не может быть намного больше периода молекулярного колебания. [12]
Это нетрудно понять, если интерпретировать т как время жизни комплекса, образовавшегося при бимолекулярной ассоциации продуктов реакции. [13]
Эффект растворителя имеет существенное значение, так как время жизни комплекса 20а в ДМСО больше, чем в метиловом спирте. Это соображение особенно верно для метанольного раствора, так как метиловый спирт будет наиболее эффективно рассредоточивать путем сольватации заряд, локализованный в основном на / г-нитрогруппе. [14]
Сделанное предполо - - жение приводит к занижению времени жизни комплекса. Дру-ггими словами, комплексы немного устойчивее, чем это следует из наших оценочных рассуждений. Вряд ли, однако, целесообразно уточнять теорию, если учесть трудности эксперимента по определению ( Ze) 3, на которые мы указывали выше. [15]
Страницы: 1 2 3 4