Мольная энтропия
Cтраница 2
Если при реакции не выделяется тепло и мольные энтропии водорода и иода при этой температуре в некотором стандартном состоянии составляют соответственно 31 2 и 53 3 кал / люль - град, то чему равна мольная энтропия йодистого водорода в том же стандартном состоянии. [16]
При этом изменяется, в основном, мольная энтропия сорбции, а энтальпийные характеристики избирательности неподвижной фазы остаются неизменными. Следовательно, для сохранения разделительных свойств колонки необходимо работать при температурах как можно более низких по сравнению с рекомендуемыми основными ВТП. [17]
Без учета изотопных эффектов найдите разность значений мольной энтропии: а) бензола и равновесной смеси изомеров дидейтеробензолов; б) бензола и орто -, мета - и пара-аи-дейтеробензолов. [18]
Таким образом, константа а равна значению мольной энтропии идеального газа, абсолютная температура и мольный объем которого равны единице. [19]
Это равенство позволяет определить при Т 0 мольную энтропию одной из конденсированных фаз, если мольные энтропии остальных известны. [20]
Теперь в согласии с формулой (5.54) определим мольную энтропию двухатомного идеального газа. [21]
Из уравнения (1.12) следует, что поведение парциальных мольных энтропии компонентов критической азеотропной смеси должно подчиняться тем же закономерностям, что и поведение парциальных мольных энтальпий и парциальных мольных объемов. [22]
ДЯ - парциальная мольная энтальпия растворения; Д5 - парциальная мольная энтропия растворения сорбата в неподвижной жидкости; AF - RT In p - свободная энергия испарения чистого сорбата; - Д / - RT In у - избыточная свободная энергия смешения. [23]
Теперь, в согласии с формулой (V.51), определим мольную энтропию двухатомного идеального газа. [24]
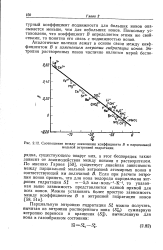 |
Соотношение между значениями коэффициента В и парциальной мольной энтропией гидратации. [25] |
По мнению Гарнея [50], существует линейная зависимость между парциальной мольной энтропией атомарных ионов и соответствующей им величиной В. Если при расчете энтропии ионов принять, что для иона водорода парциальная энтропия гидратации S % - 5 5 кал-моль 1 К 1, то указанная выше зависимость представляется единой прямой для всех ионов. [26]
Упомянутыми, а также некоторыми другими более косвенными методами рассчитана мольная энтропия большого числа химических соединений, а также парциальная мольная энтропия многих ионов в водном растворе. Полученные величины приводятся в специальных справочниках термодинамических, величин. [27]
Заметим, что фактически были уже использованы, не оговаривая этого, понятия парциальной мольной энтропии, когда в § 9.3 говорили об энтропии растворенного вещества в идеальном растворе. [28]
Если R выражать в кал / ( град - моль), то S ( мольная энтропия) выражается в тех же единицах. [29]
Это равенство позволяет определить при Т 0 мольную энтропию одной из конденсированных фаз, если мольные энтропии остальных известны. [30]
Страницы: 1 2 3