Мольная энтропия
Cтраница 3
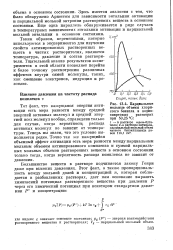 |
Парциальные мольные объемы хлористого бензила в водно-спиртовых растворах при 50 25. С. [31] |
Здесь имеется аналогия с тем, что было обнаружено Арнеттом для зависимости энтальпии активации и парциальной мольной энтропии растворенных веществ в основном состоянии. Еще одна параллель обнаруживается в ряде случаев в температурных зависимостях энтальпии активации и парциальной мольной энтальпии в основном состоянии. Таким образом, переменными, которые используются в экспериментах для изучения свойств активированных растворенных веществ в чистых растворителях, являются температура, давление и состав растворителя. Тщательный анализ результатов экспериментов в этой области позволяет перейти к более точному рассмотрению различных эффектов внутри самой молекулы, таких, как смещение электронов, индукция и резонанс. [32]
Для СбНзб определены фундаментальные термодинамические характеристики: теплоемкость в интервале температур 0 - 340 К и стандартная мольная энтропия, энтальпии образования и сублимации и рассчитаны термодинамические функции. Энтальпия разрыва связи С - Н в гидрофуллерене оказалась равной 255.4 0.8 кДж / моль, что указывает на ее высокую реакционную способность. [33]
Легко показать, что числитель и знаменатель выражения ( 10 - 6) представляют собой изменения соответственно мольных энтропии и объема при дифференциальном фазовом переходе1 жидкость - пар в рассматриваемой системе. [34]
Легко показать, что числитель и знаменатель выражения ( 10 - 6) представляют собой изменения соответственно мольных энтропии и объема при дифференциальном фазовом переходе1 жидкость - дар в рассматриваемой системе. [35]
Получим дифференциальные уравнения, носящие имя Максвелла и связывающие давление, температуру, мольный объем и мольную энтропию чистого вещества или гомогенной смеси ( раствора) постоянного состава. [36]
Поскольку мольная энтропия газа зависит от его мольного объема и, следовательно, от давления, а парциальная мольная энтропия растворенного вещества - от его концентрации, то в справочниках приводят для газов величину S, входящую в уравнение (9.7), описывающее зависимость энтропии газа от давления, а для растворенных веществ величину S, входящую в уравнение (9.33), описывающее зависимость парциальной мольной энтропии от концентрации растворенного вещества. Эти величины называют стандартными значениями энтропии. Эта же формула применима для вычисления энтропии компонента идеальной газовой смеси, если вместо Р поставить парциальное давление соответствующего компонента. [37]
Однако, поскольку распределение атомов А и С не случайно ( они не могут обмениваться местами), парциальные мольные энтропии не равны нулю. [38]
На основании данных, полученных при измерении теплоемкости, и на основании третьего закона термодинамики установлены следующие значения стандартной мольной энтропии при 298 К: Fe ( к. [39]
Таким образом, как экстраполированное к бесконечно большой температуре значение логарифма абсолютной величины удерживания ( равное или пропорциональное дифференциальной мольной энтропии сорбции), так и скорость изменения этой величины в зависимости от i / T ( определяемая дифференциальной мольной энтальпией сорбции) являются специфическими величинами, связанными с природой сорбата и сорбента. На их использовании основаны соответствующие методы хроматографической идентификации веществ, рассматриваемые ниже. Соотношения, характеризующие температурную зависимость различных величин удерживания, в том числе и абсолютных, приведены на стр. Следует иметь в виду, что линейная связь между логарифмом величины удерживания и обратной абсолютной температурой справедлива лишь в определенном температурном интервале: отклонения от линейности вызываются температурной зависимостью теплоемкости сорбата, а также изменениями фазового состояния сорбента. [40]
Из ( 18 2 5) следует, что при изобарно-изотермическом уменьшении мольной доли газа Аг в смеси его парциальная мольная энтропия увеличивается. [41]
Упомянутыми, а также некоторыми другими более косвенными методами рассчитана мольная энтропия большого числа химических соединений, а также парциальная мольная энтропия многих ионов в водном растворе. Полученные величины приводятся в специальных справочниках термодинамических, величин. [42]
Страницы: 1 2 3